
Quando um estabelecimento estrangeiro se dedica à produção de um dispositivo médico importado para os Estados Unidos (US), é obrigatório designar um US para esse estabelecimento. O US atua como ponto de contacto para qualquer comunicação US and Drug Administration (FDAUS relacionada com as instalações registadas no estrangeiro. Uma vez que esta comunicação pode ser urgente, é imperativo que o US possua um conhecimento abrangente dos FDA e seja capaz de aconselhar o estabelecimento estrangeiro sobre o cumprimento dos requisitosFDAdispositivos médicos. Além disso, ter um US independente US ajuda a evitar potenciais conflitos de interesses que podem surgir quando um parceiro comercial é designado como US . Neste blog, vamos aprofundar os detalhes do registo de um estabelecimento estrangeiro naFDA.
O que é o Registo de Estabelecimento?
O registo anual junto àFDA US FDA obrigatório para fabricantes contratados, importadores iniciais, reembaladores/re-rotuladores, desenvolvedores de especificações, etc., de estabelecimentos envolvidos na fabricação e distribuição de dispositivos médicos destinados ao mercado dos EUA, um procedimento conhecido como Registo de Estabelecimento (Título 21 CFR Parte 807).
Who deve requerer o registo de estabelecimento?
Os proprietários de instalações envolvidos na fabricação e distribuição de dispositivos médicos destinados ao uso nos US realizar um registo anual junto àFDA US . Os tipos de proprietários que podem solicitar o registo do estabelecimento são:
- Proprietários de estabelecimentos domésticos
- Proprietários de estabelecimentos estrangeiros
- Fabricantes contratuais
- Importadores iniciais
- Reembaladores/Retiquetadores
- Programadores de especificações
Quais são as etapas do processo de registo de um estabelecimento?
Para registar um estabelecimento de dispositivos médicos naFDA US , é necessário seguir as etapas descritas no fluxograma abaixo.
Figura 1: Etapas do processo de registo do estabelecimento
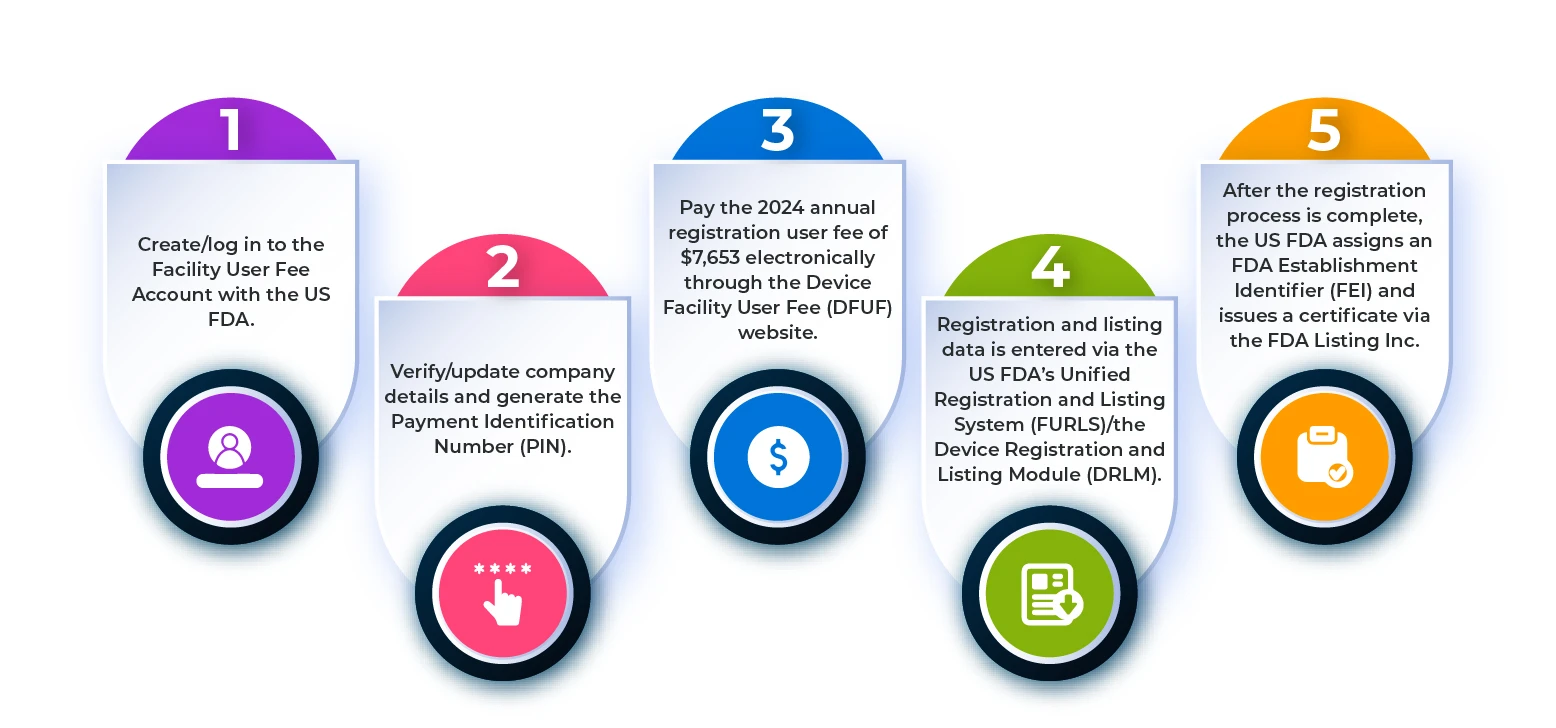
Quais são os requisitos de registo e de listagem dos estabelecimentos estrangeiros?
Compreender a importância de escolher um US independente e especializado US ajudará uma empresa estrangeira a priorizar a prevenção de qualquer conflito de interesses, o que é fundamental para as empresas que navegam no complexo mundo FDA US . As empresas estrangeiras devem reforçar a sua compreensão dos pré-requisitos para alcançar a conformidade, promover parcerias sólidas com US e preparar o terreno para um processo de registo tranquilo. A tabela abaixo descreve os requisitos de registo e listagem com base nas atividades de uma empresa estrangeira. Ela também indica quais atividades incorrem em uma taxa de registo da empresa.
Quadro 1: Requisitos de registo e de inscrição na lista com base nas actividades de um estabelecimento estrangeiro
| Atividade | Registo | Lista | Taxa de pagamento | |
| Fabricante contratado (incluindo embaladores contratados) | SIM 807.40 (a) | SIM 807.40 (a) | SIM | |
| Esterilizador por contrato | SIM 807.40 (a) | SIM 807.40 (a) | SIM | |
| Fabricantes de dispositivos personalizados | SIM 807.20 (a) (2) | SIM 807.20 (a) (2) | SIM | |
| Dispositivo que está a ser investigado ao abrigo da isenção para dispositivos de investigação (IDE) | N.o 812.1 (a) | NÃO 812.1(a),807.40 (c) | NÃO | |
| Exportador estrangeiro de dispositivos localizados num país estrangeiro | SIM 807.40 (a) | SIM 807.40 (a) | SIM | |
| Fabricantes estrangeiros (incluindo montadores de kits) | SIM 807.40 (a) | SIM 807.40 (a) | SIM | |
| Mantém os ficheiros de queixas conforme exigido pelo 21 CFR 820.198 | SIM | SIM | SIM | |
| Fabricante de acessórios que são embalados ou rotulados para distribuição comercial para fins relacionados com a saúde a um utilizador final | SIM 807.20 (a) (5) | SIM 807.20 (a) (5) | SIM | |
| Fabricante de componentes que são distribuídos apenas a um fabricante de dispositivos acabados | N.o 807.65 (a) | NÃO | NÃO | |
| Reetiquetadoras ou reembaladoras | SIM 807.20 (a) (3) | SIM 807.20 (a) (3) | SIM | |
| Remanufaturador | SIM | SIM | SIM | |
| Reprocessador de dispositivo de uso único | SIM 807.20 (a) | SIM 807.20 (a) | SIM | |
| Programadores de especificações | SIM | SIM | SIM | |
O registo de estabelecimentos junto àFDA US FDA um requisito essencial para estabelecimentos estrangeiros envolvidos na produção, venda, reembalagem ou importação de dispositivos médicos nos US. Esse registo garante a conformidade com os rigorosos regulamentos e normasFDA US . A Freyr oferece um apoio valioso aos estabelecimentos que procuram orientação especializada durante o processo de registo. Aproveitando a sua experiência e conhecimento dos regulamentosFDA US , a Freyr ajuda os estabelecimentos estrangeiros a cumprir os requisitos de conformidade, levando a uma entrada mais suave e eficiente no mercado de dispositivos US . Para saber mais sobre o processo de registo de estabelecimentos junto daFDA US , reach connosco hoje mesmo. Mantenha-se informado! Mantenha-se em conformidade!









