24 de setembro de 2016; com o prazo, a apenas um mês de distância, para a conformidade com o Identificador Único de Dispositivo (UDI) para dispositivos de Classe II, é nosso pressuposto, se não de certeza, que todos os fabricantes de dispositivos médicos estão bem equipados com um roteiro regulamentar abrangente. Para além de terem um controlo firme sobre os pré-requisitos de governação, espera-se que os fabricantes estejam preparados para a auditoria de conformidade. Desde a validação dos registos do Identificador do Dispositivo (DI) e do Identificador do Produto (PI) até à apresentação bem sucedida de GUDID, devem ter conhecimentos sobre os dados a apresentar e os procedimentos a seguir. Quer na pré-submissão, quer na pós-submissão, estar equipado com melhores conhecimentos sobre o know-how processual pode proteger os fabricantes dos desafios correspondentes relacionados com a agregação de dados, a apresentação de registos de ID e a gestão de relatórios de dispositivos, o acompanhamento de confirmações de HA, etc.
Para equipar os fabricantes com uma melhor posição em tais cenários, apresentamos aqui uma infografia rápida para compreender os desafios da conformidade UDI versus soluções, que poderá poupar o seu tempo para descodificar as complexidades da conformidade e planear melhor e estruturar o roteiro
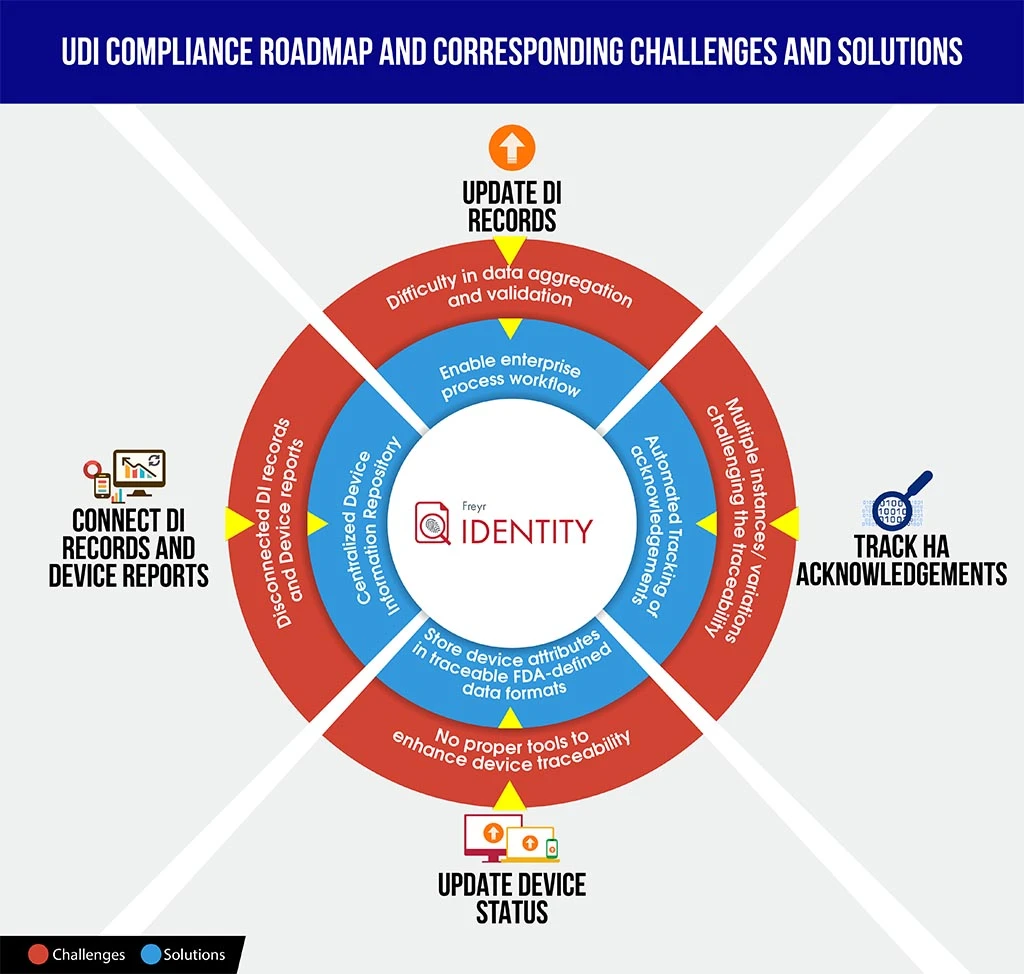
Para orientar a sua organização neste complexo processo de conformidade, Freyr o melhor dos dois mundos: uma solução de software UDI sob demanda e totalmente configurável,Freyr , bem como um Centro de Excelência (CoE) UDI que oferece os melhores serviços UDI da categoria, econômicos e personalizáveis, criados com base nas suas necessidades exclusivas e exigentes.









