
A gestão do risco é uma atividade crítica em todas as fases do ciclo de vida dos dispositivos médicos, uma vez que afecta diretamente a segurança e o bem-estar dos doentes. Os riscos são inevitáveis; no entanto, podem ser reduzidos se as empresas estiverem conscientes dos perigos iminentes e seguirem procedimentos eficazes de gestão de riscos.
A Análise dos Modos e Efeitos de Falha (FMEA) é uma ferramenta de revisão para identificar possíveis falhas numa conceção, num processo de fabrico ou montagem, ou num produto ou serviço de um dispositivo. Os "modos de falha" referem-se às formas como um dispositivo pode falhar, o que pode potencialmente afetar os doentes. A "análise de efeitos" refere-se ao exame das consequências dessas falhas. Trata-se de uma abordagem passo a passo para garantir a fiabilidade e a qualidade de um dispositivo.
Existem dois tipos de FMEAs: FMEA de conceção (DFMEA) e FMEA de processo (PFMEA). No contexto dos dispositivos médicos, os fabricantes de dispositivos utilizam a DFMEA para avaliar as falhas relativas à conceção e às especificações dos dispositivos, enquanto a PFMEA é utilizada para melhorar o processo de fabrico.
Embora a FMEA envolva o aspeto do risco, não é um sistema de gestão do risco. Os requisitos da gestão do risco são definidos pela norma ISO 14971:2019, que serve de enquadramento para os fabricantes de dispositivos médicos preverem a probabilidade de riscos e as suas consequências ao longo do ciclo de vida do produto. A metodologia FMEA de avaliação de riscos não está em conformidade com a norma ISO 14971:2019. A FMEA tem a sua própria norma internacionalmente aceite, a IEC 60812:2018, que explica como os modos de falha e a análise de efeitos são planeados, executados, documentados e mantidos. A FMEA e a ISO 14971 diferem uma da outra em certos aspetos, que são os seguintes:
Utilização normal e estado de avaria
De acordo com a norma ISO 14971, a gestão de riscos inclui tanto a utilização normal como a incorrecta do dispositivo, enquanto a FMEA inclui os riscos associados apenas à falha do dispositivo. Um exemplo simples seria o risco associado à linha intravenosa (IV). A norma ISO 14971 considera o risco potencial de infeção apesar da administração correta de uma linha intravenosa. Este risco pode dever-se a várias razões, como a baixa imunidade do doente e as infecções presentes no ambiente hospitalar/clínico. Estes riscos não são tidos em conta numa avaliação FMEA. Embora os fabricantes de dispositivos médicos não possam evitar totalmente estes riscos, podem sensibilizar os utilizadores para os riscos residuais associados à utilização do dispositivo.
Avaliação da gravidade
A ISO 14971 considera a gravidade do risco com base nos danos causados à vida das pessoas, enquanto a FMEA considera o mesmo com base nas falhas no desempenho do sistema. A gravidade do risco pode ser considerada baixa na FMEA se houver uma pequena perda de função, mesmo que isso possa levar à perda de vidas. A gravidade será considerada elevada se o dispositivo se avariar.
Por exemplo, FDA um fio-guia (Classe I) destinado a ser inserido num cateter percutâneo para direcionar o cateter através de um vaso sanguíneo. O fio-guia em questão tem o potencial de descascar o revestimento. A FMEA classificou potencialmente isso como uma gravidade de baixo risco após a avaliação, mas pode ter implicações graves na saúde do paciente.
O procedimento de avaliação do risco/modos de falha
A FMEA e a ISO 14971 diferem na forma como o risco é avaliado. Na FMEA, o risco é avaliado através da identificação de potenciais modos e efeitos de falha, seguida da classificação da gravidade das falhas. Cada uma das causas potenciais é identificada e a probabilidade de ocorrência é determinada. O risco é avaliado com base no Número de Prioridade de Risco (RPN).
Mapeamento da FMEA
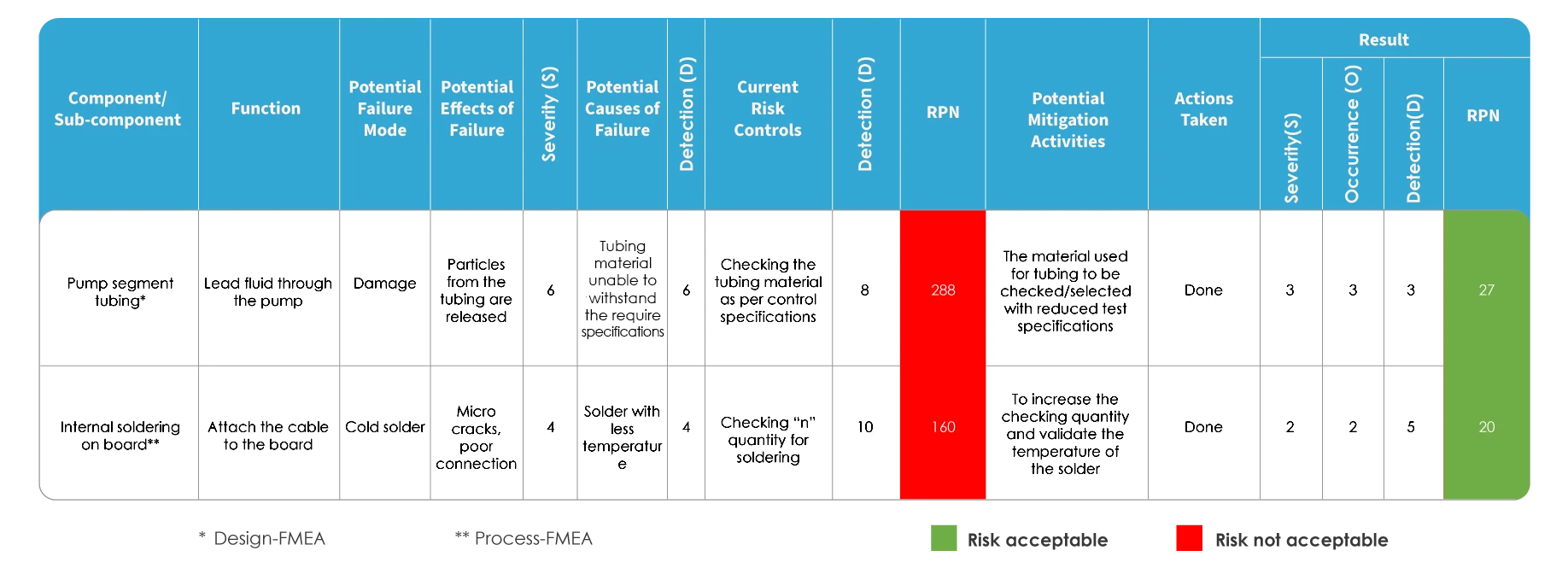
No caso do mapeamento da gestão do risco de acordo com a norma ISO 14971, é utilizada uma ferramenta de rastreabilidade conhecida como Matriz de Rastreabilidade de Perigos (HTM). Inclui análise de risco, avaliação, controlo e avaliação do risco residual.
Matriz de rastreabilidade de perigos
| Análise de risco | Risco Avaliação. | Controlo dos riscos | ||||||||||||
| ID | Perigo | Sequência ou combinação de acontecimentos razoavelmente previsíveis | Perigosos Situação | Danos | Ocorrência | Gravidade | Aceitável? | Opções de controlo dos riscos e justificação | Controlo dos riscos Medidas | Risco Controlo Verificação | Estado | Potencial de risco | Gravidade do risco | Risco residual |
| 1 | Tensão da linha | O utilizador utiliza o dispositivo | O utilizador/paciente pode ficar exposto à tensão da rede eléctrica enquanto estiver em contacto com o dispositivo | Morte do utilizador/doente | 5 | 5 | N | Segurança através de uma alteração na conceção e as medidas de proteção podem ser colocadas no lugar. | Conceção de acordo com a norma IEC 61010. | Os ensaios eléctricos devem ser realizados de acordo com a norma IEC 61010 | Feito | 2 | 2 | Y |
![]()
Tendo discutido as diferenças entre as duas, pode concluir-se que a ISO 14971 segue uma abordagem abrangente em relação à gestão do risco, enquanto a FMEA é mais uma ferramenta de fiabilidade. No entanto, os fabricantes de dispositivos médicos teriam de cumprir a ISO 14971 para satisfazer as expectativas das autoridades reguladoras relativamente às normas de gestão do risco.
Para saber mais sobre a conformidade com a norma ISO 14971:2016 e os serviços de consultoria em gestão de riscos, entre em contacto com Freyr hoje mesmo!









