Ao longo dos anos, com os avanços do software e da digitalização, registou-se uma mudança sísmica na forma como os dispositivos médicos são administrados e fornecidos. A integração de software com dispositivos médicos tem aumentado rapidamente, conduzindo a avanços incríveis no fornecimento de soluções de cuidados de saúde em vários domínios, como o diagnóstico, a prevenção de doenças e o tratamento de lesões ou doenças.
No entanto, o efeito do software na segurança e no desempenho dos dispositivos médicos tem sido duvidoso, especialmente quando o dispositivo em si é um produto exclusivamente de software. Por isso, as regulamentações relativas ao software para dispositivos médicos são constantemente revistas para determinar a consideração do software as a medical device SaMD). Recentemente, o conselho consultivo da European Commission Grupo de Coordenação de Dispositivos Médicos (MDCG) concentrou-se em melhorar as regulamentações do software para dispositivos médicos e publicou uma orientação descrevendo a abordagem a ser aplicada, ao determinar se um software é ou não um dispositivo médico. O que a orientação descreve? us .
O âmbito de aplicação das orientações
As orientações do MDCG abrangem tanto o software para dispositivos médicos como o software para dispositivos médicos para diagnóstico in vitro (IVD). De acordo com o documento, um software de dispositivo médico (MDSW) é definido como um software que se destina a ser utilizado isoladamente ou em combinação, para uma finalidade especificada na definição de "dispositivo médico" no Regulamento Dispositivos Médicos 2017/745 (MDR) ou no Regulamento Dispositivos Médicos para Diagnóstico In Vitro 2017/746 (IVDR). Descreve os critérios a aplicar para determinar se um software sujeito a revisão é ou não um dispositivo médico e pretende fornecer esclarecimentos e recomendações adicionais sobre o MDSW para os fabricantes de dispositivos médicos e outras partes.
Em primeiro lugar, o guia define os termos mais importantes utilizados no contexto do MDSW, que incluem:
Finalidade prevista: A utilização a que um dispositivo se destina, de acordo com os dados fornecidos pelo fabricante no rótulo, nas instruções de utilização ou nos materiais ou declarações promocionais ou de vendas e conforme especificado pelo fabricante na avaliação clínica.
Acessório: Um artigo que, embora não sendo ele próprio um dispositivo médico, é destinado pelo seu fabricante a ser utilizado em conjunto com um ou mais dispositivos médicos para permitir especificamente que o(s) dispositivo(s) médico(s) seja(m) utilizado(s) de acordo com a(s) sua(s) finalidade(s) prevista(s) ou para auxiliar a funcionalidade do(s) dispositivo(s) médico(s) específica e diretamente em termos da(s) sua(s) finalidade(s) prevista(s). Além disso, o MDCG menciona que o acessório de software pode conduzir ou influenciar a utilização de um dispositivo médico e as instruções de utilização e outra documentação fornecida pelo fabricante devem conter pormenores sobre a forma como o software e os acessórios adequados devem ser selecionados.
Software: representa um conjunto de instruções que processa dados de entrada e cria dados de saída.
Determinação de software para dispositivos médicos
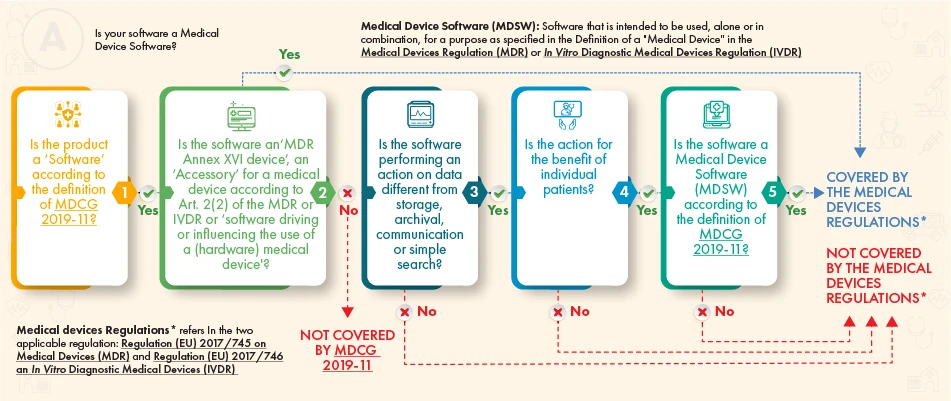
De acordo com o fluxograma de orientação acima referido, o software em questão deve ser objeto de regulamentação se satisfizer os seguintes critérios
- A definição de um dispositivo médico, de um acessório do mesmo, ou que conduza as operações do dispositivo médico, ou
- Efectua o processamento adicional de dados (não apenas o armazenamento ou a comunicação) e a sua ação cria benefícios para os doentes e satisfaz a definição de software de dispositivo médico de acordo com as orientações do MDCG
Determinação de software para dispositivos médicos de diagnóstico in vitro
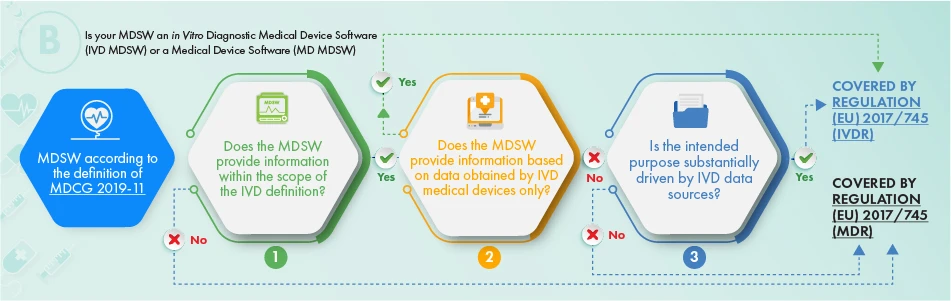
O fluxograma acima descreve a abordagem a aplicar no que respeita aos produtos destinados a fins de diagnóstico in vitro. Para determinar se o software em questão deve ser objeto de regulamentação, devem ser tidos em conta os seguintes critérios:
- A definição de um dispositivo médico, de um acessório do mesmo, ou que conduza as operações do dispositivo médico, ou
- Fornece as informações normalmente fornecidas pelos dispositivos médicos para diagnóstico in vitro e apenas as informações recolhidas a partir de um dispositivo médico para diagnóstico in vitro, ou
- O objetivo pretendido do software está relacionado com questões de IVDR
De acordo com as orientações do MDCG, o tipo de interconexão entre o software para dispositivos médicos e o dispositivo não afecta a qualificação do software como dispositivo ao abrigo do MDR e do IVDR. O software de um dispositivo médico pode existir como um produto autónomo ou ser incorporado num dispositivo de hardware e clarifica os seguintes requisitos regulamentares:
- Tendo em conta a sua qualificação e classificação, um produto de software para dispositivos médicos autónomos deve ser sujeito a todos os procedimentos regulamentares, de acordo com a legislação aplicável.
- O software de um dispositivo médico que seja um componente ou parte integrante de um dispositivo médico com hardware pode ser colocado no mercado ao abrigo do procedimento simplificado. Seria objeto de análise não separadamente, mas durante a avaliação geral do próprio dispositivo médico com hardware.
Em resumo, as orientações do MDCG abrangem os aspetos essenciais relacionados com a classificação do software para dispositivos médicos e a determinação dos requisitos regulamentares a aplicar. Os fabricantes de dispositivos médicos, os desenvolvedores de software e outras partes devem seguir e implementar as recomendações do MDCG para garantir a conformidade. Para obter mais informações sobre como determinar software as a medical device seu software as a medical device, consulte um especialista em regulamentação. Mantenha-se informado. Mantenha-se em conformidade.









