A rotulagem é parte integrante do marketing de dispositivos médicos. O rótulo é uma informação afixada no dispositivo e/ou na embalagem num formato legível pelo ser humano. O principal objetivo da rotulagem é fornecer informações de segurança aos utilizadores, que podem ser profissionais de saúde, consumidores ou qualquer outra pessoa relevante.
Todas as autoridades reguladoras globais têm determinados requisitos de rotulagem. Da mesma forma, a UE detalhou os requisitos de rotulagem no Capítulo III do Anexo I do Regulamento da UE sobre Dispositivos Médicos (EU MDR) 2017/745. O mais importante a ter em conta é incluir todos os símbolos que abrangem as informações exigidas na rotulagem do dispositivo e nos documentos (folhetos, manuais, IFUs, etc.) que o acompanham.
Algumas das considerações críticas relativas à rotulagem a ter em conta ao cumprir o Regulamento EU MDR são:
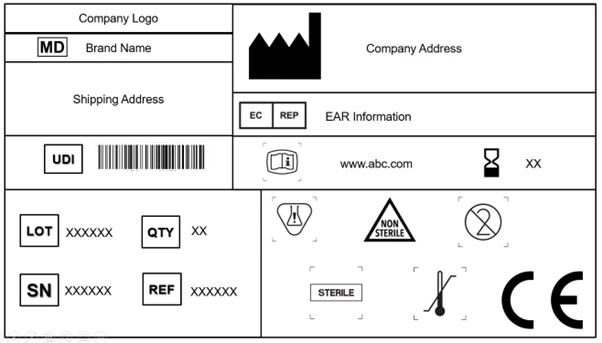
1. Simbologia de rotulagem de dispositivos médicos
Todos os fabricantes são obrigados a incorporar o símbolo de dispositivo médico, que indica que o produto fornecido ao mercado da UE é um dispositivo médico. É obrigatório apor este símbolo no dispositivo e em todos os níveis da embalagem. Além disso, o rótulo deve projetar a designação comercial e o nome original do dispositivo.
2. Dispositivos especiais
No caso de o produto ser um dispositivo especial ou personalizado, o estatuto do mesmo deve ser mencionado na rotulagem. Por exemplo, se o objetivo do produto for apenas a investigação clínica, o rótulo deve indicá-lo explicitamente.
No caso dos dispositivos com materiais absorventes ou que se possam dispersar localmente no corpo humano, a rotulagem deve mencionar a composição do material e pormenores quantitativos sobre os principais constituintes.
A rotulagem explícita também é necessária no caso dos dispositivos de utilização única e dos dispositivos esterilizados. Para os dispositivos reprocessados, a rotulagem deve mencionar o número de vezes que podem ser reprocessados, o número de vezes que foram reprocessados até à data e o método de esterilização utilizado.
3. Presença de substâncias tóxicas
A declaração da presença de substâncias CMR (carcinogénicas, mutagénicas, tóxicas para a reprodução) e de substâncias desreguladoras do sistema endócrino é obrigatória nos rótulos se a concentração for superior a 0,1% p/p. A lista dessas substâncias deve ser afixada no dispositivo e/ou na embalagem.
Além disso, deve ser afixado nos dispositivos um rótulo sobre a presença de derivados do sangue e dos tecidos (mesmo quando contidos na substância medicinal do dispositivo combinado).
4. Normas harmonizadas
EU MDR reconhece e aceita a norma ISO 15223-1: 2021. O documento determina os símbolos a serem utilizados na rotulagem de dispositivos médicos e suas embalagens. O capítulo 3 (23.1,h) do anexo I do EU MDR que podem ser utilizados símbolos internacionalmente reconhecidos e, no caso de regiões onde esses símbolos não são reconhecidos, a descrição dos mesmos deve ser fornecida num documento juntamente com o dispositivo.
5. UDI
Os artigos 27.º, 28.º, 29.º e o Anexo VI (A, B, C) descrevem pormenorizadamente as regras e os regulamentos relativos à UDI. O rótulo é agora obrigado a conter um suporte de UDI [Identificação Automatizada para Captura de Dados (AIDC) e representação de Interpretação Legível por Humanos (HRI) da UDI] no dispositivo e também nos níveis superiores de embalagem. A embalagem superior do dispositivo (excluindo as embalagens de envio) terá o seu próprio suporte UDI.
6. Informação eletrónica para utilização (eIFU)
O endereço Web (URL) sob a forma de eIFUs também pode ser colocado na rotulagem dos dispositivos médicos juntamente com as IFUs em papel. As eIFUs podem ser utilizadas no caso de dispositivos médicos implantáveis, implantáveis activos, fixos e de software (também destinado a leigos).
7. Informações sobre os operadores económicos (OE)
O rótulo contém normalmente as informações do fabricante. No entanto, no caso de fabricantes estrangeiros, a informação do representante autorizado deve ser colocada nos rótulos comerciais.
8. Avisos e precauções
As advertências e precauções devem ser mencionadas no rótulo do dispositivo. A informação sobre este aspeto pode ser mínima, e os pormenores sobre o mesmo podem ser fornecidos nas instruções de utilização.
Os fabricantes também têm de se habituar aos requisitos de rotulagem específicos de cada país. O requisito linguístico depende do Estado-Membro da UE. Pode ter um grande impacto na rotulagem, nas instruções de utilização e na embalagem do dispositivo em termos de tempo e custos.
Estes requisitos adicionais podem aumentar ainda mais os encargos do fabricante com a complexidade do processo de rotulagem existente. A falha no mesmo pode tornar-se muito dispendiosa, envolvendo recolhas de produtos e subsequentes passos para a Ação Corretiva e Preventiva (CAPA).
Procura assistência na rotulagem de acordo com o EU MDR? Freyr serviços completos em rotulagem de dispositivos médicos. Entre em contacto com os nossos especialistas em regulamentação agora mesmo em – sales@freyrsolutions.com










