Globalmente, as agências de saúde exigem que os fabricantes estrangeiros de dispositivos médicos e IVD nomeiem um representante local. No Japão, de acordo com a Lei revisada de Produtos Farmacêuticos e Dispositivos Médicos (PMD), o sistema In-Country Caretaker (ICC) foi substituído pelo sistema Autorização de Introdução no Mercado (MAH). De acordo com esse sistema, as empresas devem obter uma licença MAH para obter a aprovação do dispositivo e comercializá-lo no Japão.
Autorização de Introdução no Mercado (MAH) deve ser uma entidade local situada no Japão. Os fabricantes nacionais podem obter diretamente a licença MAH, enquanto os fabricantes estrangeiros devem identificar uma entidade local para cumprir este requisito MAH.
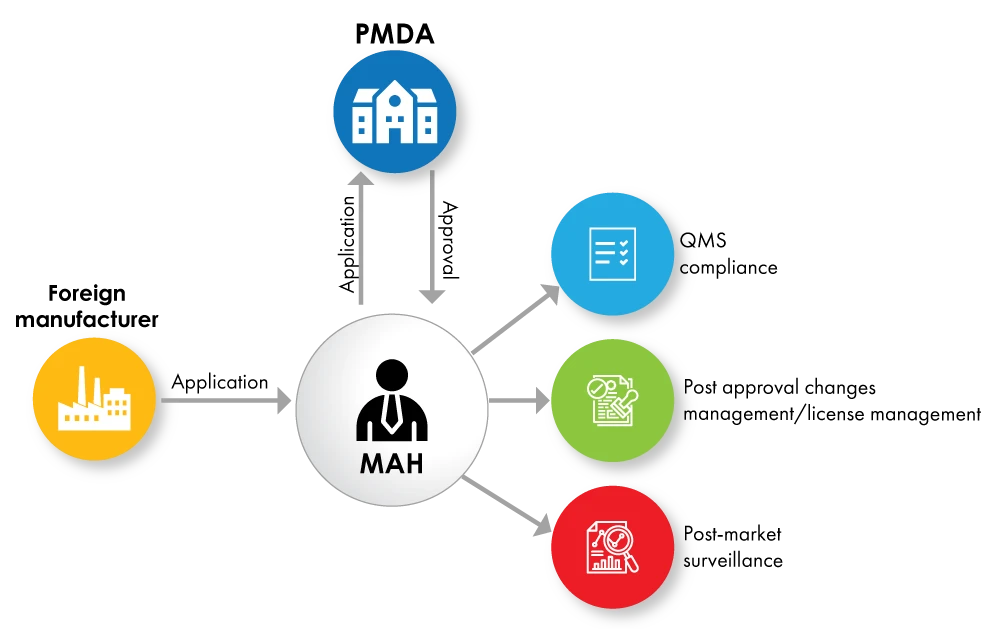
Fig. nº 1: Fluxograma de registo de dispositivos com o MAH como titular da licença
Se os fabricantes estrangeiros não desejarem conceder a propriedade total do produto ao MAH, eles podem nomear um Autorização de Introdução no Mercado Designado (DMAH). O DMAH submete a submissão nome do fabricante estrangeiro, e a aprovação é concedida ao fabricante estrangeiro para o dispositivo.
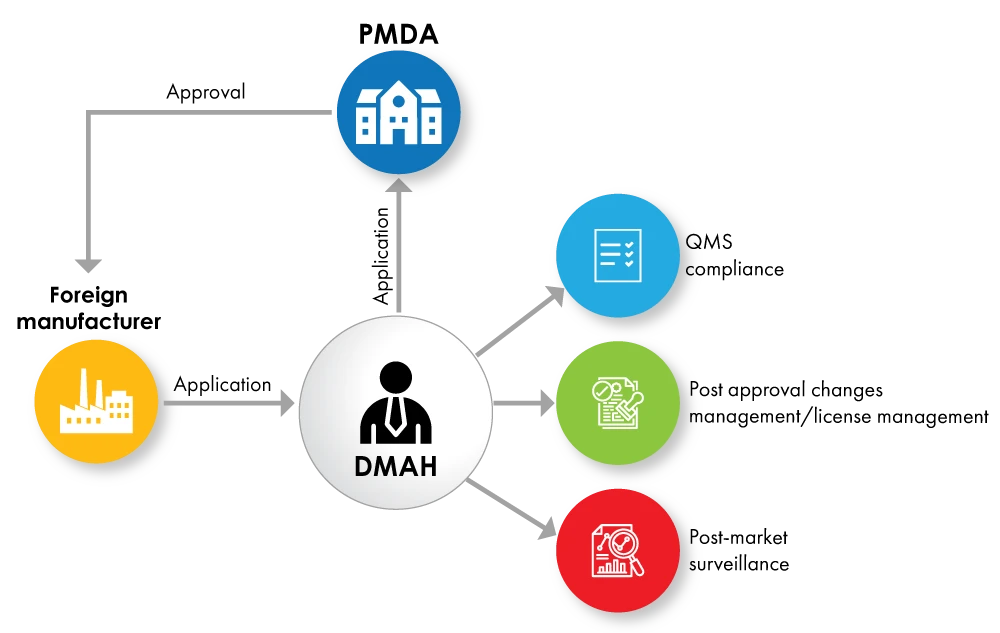
Fig. 2: Fluxograma de registo de dispositivos com a DMAH como titular da licença
Existem três (03) opções possíveis através das quais o fabricante estrangeiro pode cumprir os requisitos PMDArelativos ao MAH. Os fabricantes estrangeiros devem avaliar cuidadosamente todas as três (03) possibilidades. Estas incluem:
Estabelecer uma filial no Japão
Os fabricantes estrangeiros podem estabelecer um escritório local no Japão e atuar como MAH para lançar os seus produtos no Japão. Isso permite que o fabricante estrangeiro tenha total propriedade e visibilidade completa dos seus produtos no Japão. Essa pode não ser a opção preferida para fabricantes de pequeno porte, pois os custos associados à criação de uma subsidiária no Japão e à manutenção dos requisitos de qualidade do Ministério da Saúde, Trabalho e Bem-Estar ( MHLW) são bastante elevados.
Distribuidor como MAH
É uma forma económica para fabricantes estrangeiros que não têm um escritório local no Japão. Os importadores ou distribuidores podem ser nomeados como MAH ou DMAH. Considerando a receita gerada pelas vendas de dispositivos, os importadores e distribuidores geralmente não cobram taxas adicionais para atuar como MAH ou DMAH. Os fabricantes, no entanto, enfrentam desafios para alcançar a penetração no mercado, pois o distribuidor que atua como MAH pode não estar aberto a emitir um Certificado de Não Objeção (NoC) para outros distribuidores. Os distribuidores, às vezes, não cooperam com o fabricante estrangeiro na mudança do MAH e na transferência da licença do dispositivo para o MAH/DMAH recém-identificado.
Aliança com terceiros
Os fabricantes estrangeiros podem nomear um prestador de serviços independente como seu MAH/DMAH. A confidencialidade do dispositivo está bem protegida e o fabricante estrangeiro controla a propriedade legal do produto. Os fabricantes podem implementar e concretizar os seus planos de expansão do mercado.
Autorização de Introdução no Mercado Responsabilidades Autorização de Introdução no Mercado
Um titular de AIM/DMAH actua como representante em nome do fabricante estrangeiro e presta assistência na aprovação de dispositivos no Japão. As principais responsabilidades de um titular de AIM/DMAH incluem:
- Aprovação End-to-end
- Assegurar que os dispositivos seguros e de qualidade entram no mercado japonês através da gestão adequada do fabrico e do controlo de qualidade dos produtos
- Ser responsável pela liberação do dispositivo para a parte que detém uma licença de venda/distribuição de dispositivos médicos
- Gestão Post-Market Surveillance (PMS)
Como o MAH/DMAH deve seguir todas as medidas de segurança, Quality Management System (QMS) e Boas Práticas de Vigilância (GVP) em nome do fabricante estrangeiro, é extremamente importante escolher o MAH/DMAH certo. Portanto, os fabricantes estrangeiros devem avaliar minuciosamente todas as opções antes de optar pelo melhor modelo de MAH possível. Isso inclui realizar uma análise de viabilidade, determinar o RoI, o relacionamento com os importadores e distribuidores, o orçamento disponível, o tamanho do portfólio, o lucro com as vendas do dispositivo, os prazos para o lançamento do dispositivo, etc. Os fabricantes devem escolher meticulosamente se concedem a propriedade do dispositivo ao MAH ou se nomeiam um DMAH e mantêm a propriedade consigo.
Para saber mais sobre os requisitos MAH/DMAH no Japão, reach com um especialista em regulamentação da Freyr. Mantenha-se informado. Mantenha-se em conformidade.









