
O Regulamento sobre Dispositivos Médicos (MDR) da União Europeia (UE) tem sido notícia há algum tempo. O MDR substituiu a Diretiva sobre Dispositivos Médicos (MDD) e a Diretiva sobre Dispositivos Implantáveis Ativos (AIMDD). Inicialmente, toda a transição deveria estar em vigor em maio de 2020; no entanto, devido ao surgimento da pandemia da COVID-19, a implementação foi adiada para 26 de maio de 2021. Nesse cronograma, até 26 de maio de 2024, todos os certificados MDD serão anulados e os fabricantes de dispositivos deverão estar em conformidade com o EU MDR. Além disso, os dispositivos MDD legalmente colocados no mercado de acordo com as Diretivas 90/385/CEE e 93/42/CEE antes de 26 de maio de 2020 e os dispositivos colocados no mercado a partir de 26 de maio de 2020, em virtude de um certificado, continuarão disponíveis no mercado até 27 de maio de 2025. Os prazos estão descritos abaixo –
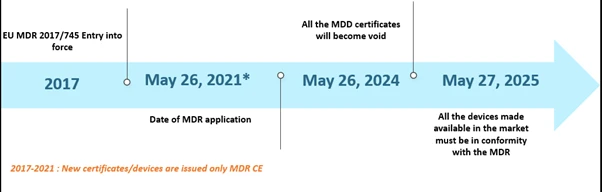
Cronograma do cenário EU MDR
No entanto,a capacidade limitada dos Organismos Notificados (ONs) e a falta de preparação dos fabricantes colocaram alguns desafios na implementação do MDR dentro do prazo estabelecido. Em outubro de 2022, havia um total de trinta e oito (38) organismos notificados (ONs), que receberam cerca de 8120 pedidos de EU MDR , dos quais 1990 certificados foram emitidos. De acordo com as estimativas iniciais, apenas 7000 certificados poderiam ser processados, o que levou à prorrogação do prazo. Além disso, uma das outras razões prováveis para a prorrogação foi garantir a disponibilidade contínua de dispositivos médicos seguros cujos certificados já expiraram ou expiram antes de 26 de maio de 2024. O cenário atual para o prazo prorrogado é descrito abaixo.
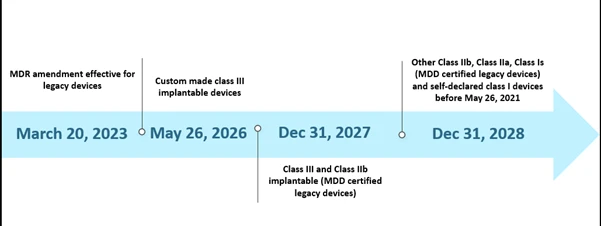
Cronograma do cenário EU MDR
A nova extensão é aplicável a dispositivos antigos que cumpram o artigo 120 (3e) com um MDD CE válido ou derrogação em 20 de março de 2023, e permanecerão no mercado juntamente com os dispositivos com marcação CE MDR. Até 26 de maio de 2024, os fabricantes de dispositivos legados devem ter um SGQ implementado e ter apresentado um submissão um organismo notificado designado pela MDR para avaliação da conformidade e, até 26 de setembro de 2024, os fabricantes de dispositivos legados devem ter um acordo com um organismo notificado designado pela MDR.
Vejamos agora o impacto que os fabricantes poderão ter com esta extensão.
Oportunidades que os fabricantes têm com esta extensão:
- Acesso alargado ao mercado para os fabricantes de dispositivos certificados pela MDD/AIMDD que já tenham tomado as iniciativas de conformidade com o MDR.
- Os fabricantes certificados MDR cujos certificados MDD/AIMDD CE não tenham sido revogados são autorizados a colocar no mercado dispositivos antigos até ao final do período de transição, para além dos seus dispositivos conformes com o MDR.
- Os fabricantes que tiverem uma derrogação nacional a partir de 20 de março de 2023 poderão beneficiar do período de transição.
- O período de prorrogação dá mais tempo para uma melhor compreensão das regras e regulamentos, o que ajuda a simplificar o processo e a atingir a conformidade com o RDM.
Desafios que poderão surgir para os fabricantes com esta extensão:
- Não há benefício de mercado para os fabricantes de dispositivos antigos que não quiseram cumprir o MDR.
- A prorrogação do RDM pode fazer com que os processos de certificação se arrastem e atrasem o lançamento de produtos, o que é um resultado direto da acumulação de análises pelos ON.
Que medidas devem os fabricantes tomar?
- É imperativo que os fabricantes determinem a classe de risco do RDM do seu dispositivo médico para identificar prontamente o calendário de transição adequado, de acordo com os regulamentos RDM alterados.
- Para garantir a conformidade com os regulamentos do RDM, é crucial identificar e iniciar a comunicação com os RN designados pelo RDM que possuam a competência específica necessária para a classificação do seu dispositivo médico.
- É fundamental efetuar uma avaliação exaustiva das lacunas do seu dispositivo médico certificado ao abrigo da MDD/AIMDD, identificar e resolver quaisquer não conformidades com os regulamentos do RDM e garantir a conformidade atempada.
É essencial que os fabricantes tomem medidas imediatas para garantir a conformidade com o MDR. O prazo prolongado oferece algumas oportunidades para os fabricantes alcançarem a conformidade com o MDR, mas também apresenta desafios, como atrasos nos processos de certificação e o custo da conformidade. Para superar esses desafios e aproveitar as oportunidades, deixe a nossa equipa de profissionais ajudá-lo no processo de conformidade com o MDR e garantir o seu sucesso neste ambiente regulatório desafiador. Marque uma reunião us para saber mais sobre como podemos ajudá-lo a alcançar a conformidade com o MDR e manter-se à frente da concorrência. Mantenha-se informado. Mantenha-se em conformidade.









