
Qual é o papel da cibersegurança nos dispositivos médicos?
O processo de aprovação 510(k)é um caminho regulatório utilizado pela Food and Drug Administration (FDAUS para avaliar e aprovar a distribuição comercial de dispositivos médicos. O processo visa garantir que os dispositivos médicos sejam seguros e eficazes para uso pelos pacientes.FDA US FDA cibersegurança como «o processo de prevenção de acesso não autorizado, modificação, uso indevido ou negação de uso, ou o uso não autorizado de informações armazenadas, acessadas ou transferidas de um dispositivo médico para um destinatário externo».
Os dispositivos médicos estão cada vez mais ligados a redes e, por isso, são vulneráveis a ameaças de cibersegurança, como pirataria informática, violações de dados e ataques de malware. Abordar a cibersegurança na fase de conceção e desenvolvimento é fundamental para garantir que os dispositivos médicos dispõem de controlos de segurança adequados. As ameaças e vulnerabilidades não podem ser eliminadas, e a redução dos riscos de cibersegurança é especialmente difícil. Se a cibersegurança não for mantida corretamente, pode levar ao comprometimento da funcionalidade dos dispositivos, à perda de dados pessoais ou médicos e à possibilidade de as ameaças à segurança se propagarem a outras redes ou dispositivos interligados.
Incidentes causados por cibersegurança comprometida
Incidentes de cibersegurança tornaram dispositivos médicos e redes hospitalares inoperantes, resultando na interrupção da prestação de cuidados aos pacientes em instalações de saúde nos US. Esses ciberataques e explorações também podem causar danos aos pacientes devido a riscos clínicos, por exemplo, atrasos no diagnóstico e/ou tratamento dos pacientes.
A lista abaixo apresenta os principais incidentes ocorridos no sector da saúde que sublinham a importância da cibersegurança para a segurança dos doentes.
- Em 2017, o ataque de ransomware WannaCry afectou sistemas hospitalares e dispositivos médicos em todo o mundo.
- Em 2020, um ataque de ransomware a um hospital alemão pôs em evidência os potenciais oitenta e três (83) impactos do atraso nos cuidados aos doentes, uma vez que o ataque obrigou a desviar os doentes para outro hospital.
As principais considerações de cibersegurança para a autorização 510(k)
A seguir estão os princípios gerais de cibersegurança para fabricantes de dispositivos médicos, de acordo com as orientaçõesFDA US específicas para submissões pré-comercialização.
- Regulamento do Sistema de Qualidade (QSR):Os fabricantes devem abordar as questões de cibersegurança na fase de conceção e desenvolvimento do dispositivo médico, pois isso pode resultar numa mitigação mais robusta e eficiente dos riscos para os pacientes. Os fabricantes devem estabelecer entradas de conceção relacionadas com a cibersegurança para os seus dispositivos e uma abordagem de vulnerabilidade e gestão da cibersegurança como parte da validação do software e da análise de risco exigidas pela 21 CFR 820.30(g).
- Segurança do design:Os fabricantes de dispositivos devem garantir que os seus produtos sejam projetados tendo em mente a segurança do dispositivo. AFDA US FDA a adequação da segurança com base na capacidade do dispositivo de fornecer e implementar objetivos de segurança, como autenticidade, autorização, disponibilidade, confidencialidade e segurança, além de atualização oportuna em toda a arquitetura do sistema.
- Transparência: A falta de informação sobre cibersegurança no dispositivo, como a informação necessária para integrar o dispositivo no ambiente de utilização, bem como a informação necessária aos utilizadores para manter a cibersegurança durante o ciclo de vida do dispositivo, pode afetar a sua segurança e eficácia. Para responder a estas preocupações, é importante que os utilizadores dos dispositivos tenham acesso às informações relativas aos controlos de cibersegurança, aos riscos potenciais e a outras informações pertinentes.
- Documentação de apresentação: Espera-se que a conceção e a documentação da cibersegurança dos dispositivos sejam dimensionadas de acordo com o risco de cibersegurança de um dispositivo. Os fabricantes devem ter em conta o sistema mais alargado em que um dispositivo pode ser utilizado.
Figura 1: Desafios e soluções comuns em matéria de cibersegurança 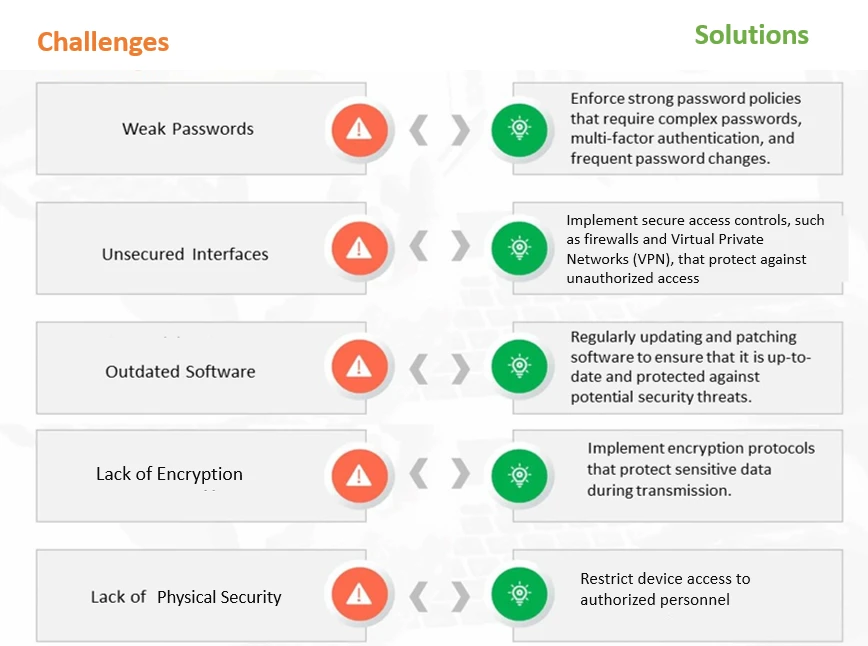
Conclusão
Em resumo, a cibersegurança em dispositivos médicos é crucial para garantir a segurança do paciente e prevenir incidentes que possam interromper a prestação de cuidados de saúde. Os regulamentosFDA US enfatizam a necessidade de os fabricantes abordarem as questões de cibersegurança durante a conceção e o desenvolvimento de dispositivos médicos e fornecerem informações transparentes sobre os controlos de cibersegurança. O QSR, a segurança da conceção, a transparência e a documentação de submissão são considerações fundamentais para a aprovação 510(k). Também é importante abordar desafios comuns de cibersegurança, como vulnerabilidades em componentes de terceiros e ataques de ransomware, e implementar soluções como análises de risco robustas e atualizações regulares de software.
Para experimentar um processo de autorização 510(k) sem complicações e em conformidade, entre em contacto com os nossos especialistas em regulamentação. Mantenha-se informado! Mantenha-se em conformidade!









