
Com a visão da rastreabilidade global dos dispositivos, o Ministério da Segurança dos Alimentos e dos Medicamentos (MFDS) da Coreia do Sul sugeriu/exigiu? um novo requisito regulamentar para a incorporação do sistema de identificação única do dispositivo (UDI) nos dispositivos médicos. O registo de dispositivos médicos e a UDI são procedimentos integrados, e a UDI é um pré-requisito para o estabelecimento de dispositivos médicos no mercado coreano. Para garantir a segurança dos doentes, o MFDS introduziu o Sistema Integrado de Informação sobre Dispositivos Médicos (IMDIS) em 2016, uma plataforma para regular a rastreabilidade dos dispositivos médicos na Coreia do Sul.
De acordo com o artigo 2.º da Lei sobre Dispositivos Médicos que especifica os regulamentos sobre dispositivos médicos UDI, um sistema UDI inclui os números e códigos de barras indicados no recipiente e na embalagem, etc., de dispositivos médicos num sistema normalizado para os identificar e gerir de forma completa e eficaz. O MFDS espera que os fabricantes registem as informações na plataforma IMDIS. O IMDIS é utilizado para ligar eletronicamente o sistema de informação relacionado com os dispositivos médicos.

Fonte: Easy Medical Device
A UDI consiste num código de barras legível por máquina que inclui:
- Identificador do dispositivo - uma combinação de números ou alfabetos gerados exclusivamente para cada produto na UDI
- Identificador do produto - uma combinação de números ou letras gerada pela unidade de produção na UDI. Inclui o número de fabrico (lote, número de série), a data de produção e a informação sobre a versão do produto
Prazos para incorporar os requisitos de UDI na embalagem de dispositivos médicos:
Como parte da revisão da Lei dos Dispositivos Médicos em 2016, o IMDIS foi introduzido para compreender e efetuar um rastreio sistemático dos dispositivos. Após a aplicação bem-sucedida da plataforma IMDIS, a incorporação da UDI na embalagem foi efectuada de forma faseada, tendo a UDI sido tornada obrigatória, como se pode ver na imagem abaixo.
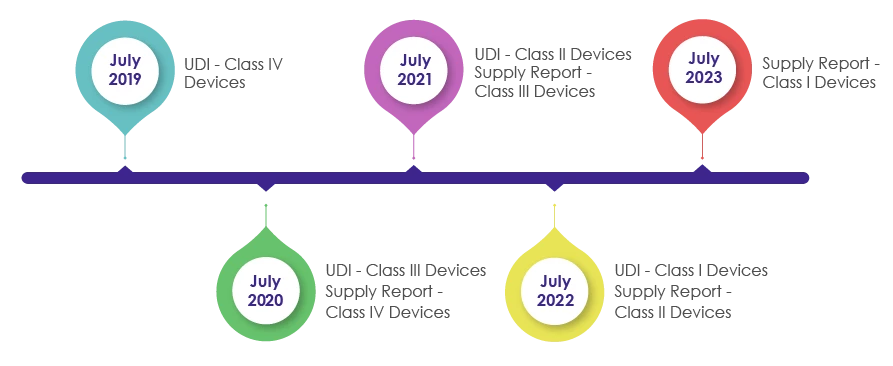
O MFDS exige que os fabricantes, vendedores e fornecedores de dispositivos médicos registem os dados dos dispositivos fornecidos e forneçam as informações de fornecimento (que incluem o fornecedor, o número de lote, a unidade de embalagem, a quantidade, a data, o preço unitário por preço de venda) no relatório de fornecimento no UDI.
Processo de geração de uma UDI:
Os fabricantes ou importadores de dispositivos médicos devem atribuir um UDI aos seus dispositivos por nome do modelo e unidade de embalagem, nos termos do artigo 3.º, n.º 2, antes de expedir dispositivos médicos que sejam autorizados, certificados ou comunicados. Quando o UDI for marcado como um código de barras, deve ser utilizado o Sistema Internacional Padrão GS1. Para o UDI-DI, deve ser utilizado um código Global Trade Item Number (GTIN), enquanto que para o UDI-PI, devem ser utilizados submissão GS1 (AI).
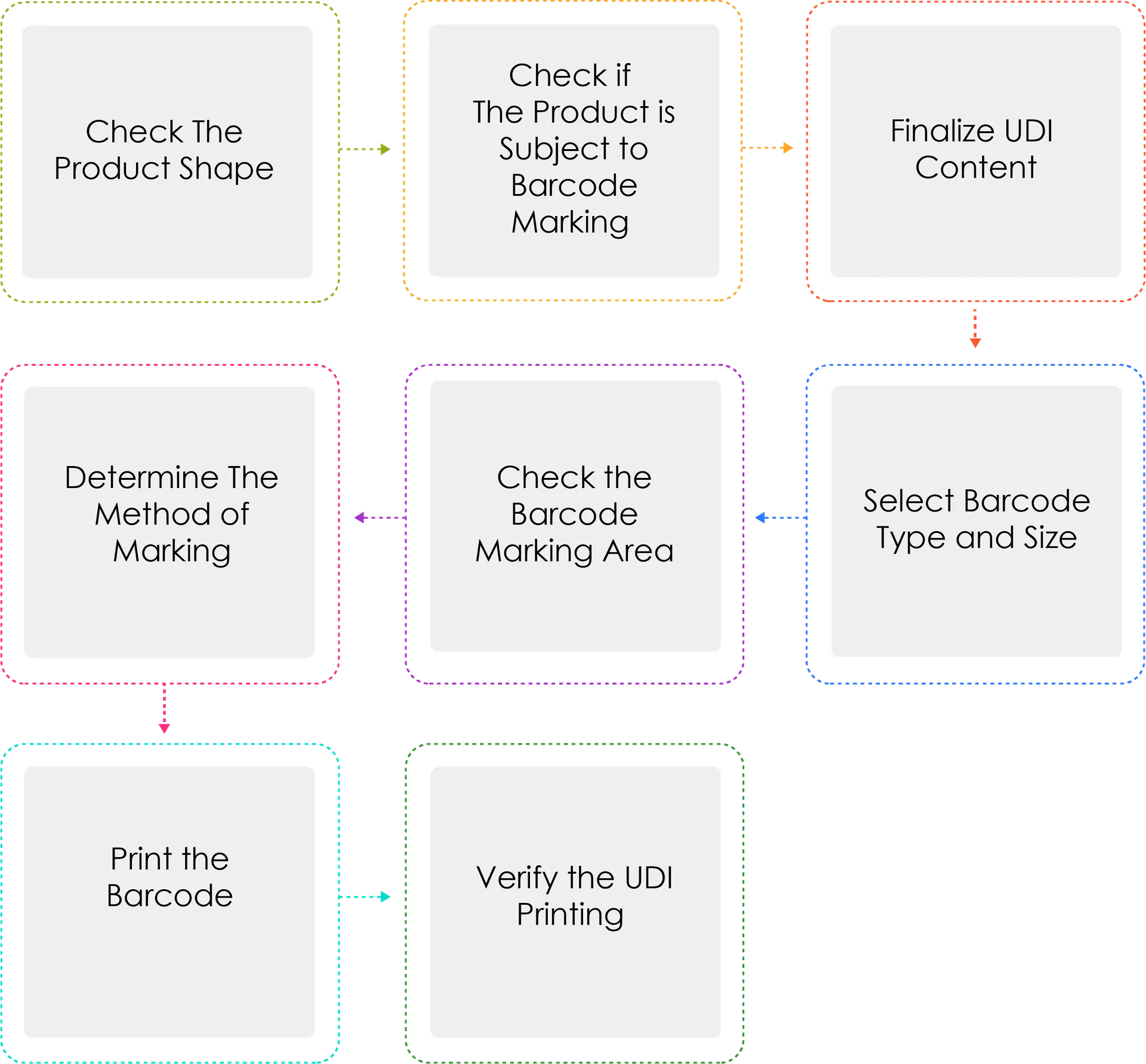
Porque é que Determinar o método de marcação escrito três vezes?
Com a implementação dos requisitos de conformidade com a UDI, a MFDS pode simplificar as actividades pré-comercialização (ou seja, conformidade com o SGQ, avaliação de ensaios clínicos e aprovação global), bem como as actividades pós-comercialização (ou seja, comunicação de EA, recolhas) dos dispositivos. A tentativa consciente da MFDS de rastrear e monitorizar os dispositivos garantirá a segurança e a eficácia dos dispositivos no mercado sul-coreano.
Para saber mais sobre a conformidade com a UDI e o processo de registo de dispositivos médicos na Coreia do Sul, reach com Freyr.









