
Os dispositivos médicos passam por uma avaliação de conformidade antes de serem incluídos na lista ARTG para garantir que cumprem os princípios essenciais exigidos pela Administração de Produtos Terapêuticos (TGA) da Austrália. Os princípios essenciais basicamente descrevem as características de segurança e desempenho que qualquer dispositivo deve cumprir para poder ser vendido na Austrália. Semelhante ao processo na UE, a avaliação de conformidade na Austrália é baseada na classe de risco do dispositivo. Portanto, o caminho de avaliação de conformidade a ser seguido por qualquer dispositivo depende da sua classificação.
Existem várias normas regulamentares que se aplicam a vários tipos de dispositivos. O cumprimento de uma ou mais normas é um requisito essencial. A identificação das normas relevantes aplicáveis ao dispositivo e os testes subsequentes do dispositivo para demonstrar a sua conformidade com a norma tornam-se um pré-requisito.
A avaliação da conformidade envolve uma análise sistemática dos documentos técnicos relacionados com o dispositivo. A gestão de riscos, a avaliação clínica, o processo de fabrico envolvido e as atividades de vigilância realizadas pelo fabricante são as áreas críticas para avaliação. Os dispositivos que precisam de um certificado de Avaliação de Conformidade da TGA estão listados no Regulamento 4.1 dos Regulamentos de Produtos Terapêuticos (Dispositivos Médicos) de 2002. Embora um certificado de avaliação da conformidade emitido pela TGA seja um pré-requisito para a comercialização da maioria dos dispositivos médicos na Austrália, a TGA também aceita certificados de avaliação da conformidade emitidos pelos organismos notificados na Europa. Além disso, a TGA também aceita avaliações da conformidade de países que fazem parte do MDSAP Medical Device Single Audit Program).
Os requisitos de avaliação da conformidade variam de acordo com a categoria de risco do dispositivo. A Tabela n.º 1 detalha o processo de avaliação da conformidade com base na classificação na Austrália.
Processo de Avaliação da Conformidade - Austrália
Classe | Procedimento de Avaliação da Conformidade | Responsabilidades do fabricante |
| I | Parte 6 (Declaração de Conformidade, sem necessidade de avaliação pelo Secretário) | Documentação para comprovar a conformidade com os Princípios Essenciais |
| I (medição) e IIa (não esterilizado) | Parte 6 (Declaração de Conformidade, não exigindo avaliação pelo Secretário) Parte 5 (Sistema de gestão da qualidade do produto) | Documentação que comprove a conformidade com os Princípios Essenciais. Implementar um sistema de gestão da qualidade do produto para inspeção final e testes para auditorias. Nota: Não é necessário apresentar a Declaração de Conformidade para a Classe I (não medidora e não esterilizada), mas ela deve estar disponível mediante solicitação da TGA. |
| I (estéril) e IIa (estéril) | Parte 6 (Declaração de Conformidade, sem necessidade de avaliação pelo Secretário) Parte 4 (Garantia da Qualidade da Produção) | Documentação que comprove a conformidade com os Princípios Essenciais. Implementar um sistema de gestão da qualidade que exclua o elemento de design, com base na norma ISO 13485. |
| IIb | Parte 1 (Garantia de qualidade total), excluindo a Cláusula 1.6 (Análise do projeto) | Implementar um sistema completo de gestão da qualidade, incluindo design, produção, rotulagem, embalagem e inspeção final, com base na ISO 13485. Exclui o dossiê de design. |
| III e AIMD | Parte 1 (Garantia de qualidade total), incluindo a Cláusula 1.6 (Análise do projeto) | Implementar um sistema completo de gestão da qualidade, incluindo design, produção, rotulagem, embalagem e inspeção final, com base na ISO 13485. Dossiê de projeto em conformidade com os Princípios Essenciais. |
| Sistemas ou Pacotes de Procedimentos Parte 7 | (Procedimentos para dispositivos médicos utilizados para fins especiais) | Princípios essenciais. Procedimento de avaliação da conformidade. Evidência clínica para cada componente individual do sistema ou pacote. |
Tabela n.º 1. Requisitos de avaliação da conformidade dos dispositivos
O processo habitual de aprovação de dispositivos médicos pela TGA é o seguinte:
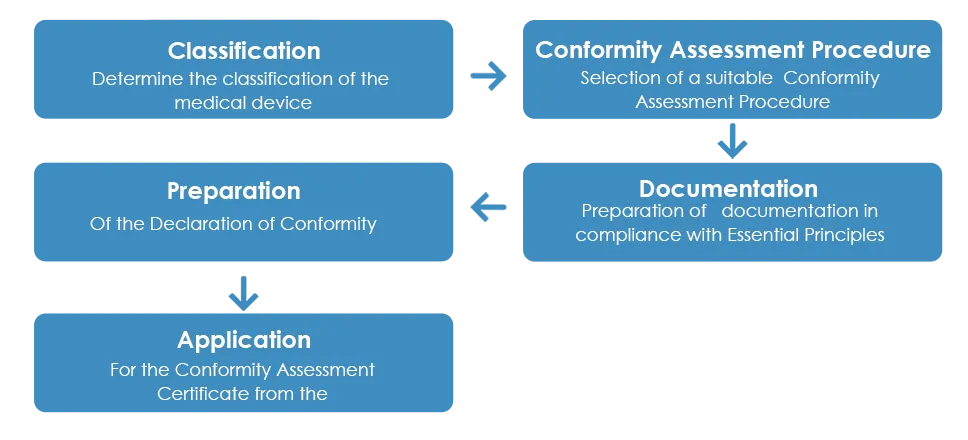
Conforme detalhado acima, uma vez recebido o Certificado de Avaliação de Conformidade da TGA, o fabricante deve preparar uma Declaração de Conformidade (DoC) declarando que o dispositivo médico está em conformidade com os princípios essenciais aplicáveis, as regras de classificação e a rota de avaliação de conformidade. No entanto, ao contrário do Certificado de Avaliação de Conformidade, uma DoC europeia não é aceita pela TGA.
O mercado australiano oferece um panorama promissor para os fabricantes de dispositivos médicos, desde que os requisitos regulamentares da Administração de Produtos Terapêuticos (TGA) sejam cumpridos. Os requisitos de conformidade e o processo de avaliação variam de acordo com a classe de risco do dispositivo e do IVD. Embora as regulamentações para dispositivos médicos sejam bem definidas e transparentes, navegá-las é complexo e os fabricantes podem buscar apoio de parceiros regulatórios para o registro bem-sucedido do dispositivo.
Para obter informações completas sobre os requisitos de avaliação de conformidade, patrocinador australiano e listagem ARTG na Austrália,entre em contacto com um especialista regulatório comprovado. Mantenha-se informado. Mantenha-se em conformidade.









