
Quality Management System (QMS) um componente essencial da indústria de dispositivos médicos, garantindo a segurança, a eficácia e a conformidade regulamentar dos dispositivos médicos ao longo do seu ciclo de vida. O SGQ é implementado em todas as etapas do ciclo de vida do dispositivo médico, incluindo a fase de projeto e desenvolvimento, para garantir que o dispositivo atenda aos requisitos regulamentares e do utilizador e que quaisquer riscos potenciais sejam identificados e tratados.
Figura 1 - Fases do ciclo de vida dos dispositivos médicos
Neste blogue, discutiremos a importância do SGQ na fase de conceção e desenvolvimento do ciclo de vida dos dispositivos médicos.
Fase de conceção e desenvolvimento no ciclo de vida dos dispositivos médicos
A fase de conceção e desenvolvimento é uma das fases mais críticas do ciclo de vida de um dispositivo médico. Durante esta fase, a conceção do dispositivo é desenvolvida e são criados protótipos, seguidos de testes de verificação e validação como parte do ciclo de vida do dispositivo médico.
Para garantir que o dispositivo médico cumpra os requisitos regulamentares, segurança, eficácia e expectativas do utilizador, a implementação de um Quality Management System (QMS) é essencial na fase de conceção e desenvolvimento do ciclo de vida de um dispositivo médico.
A documentação é crucial durante a fase de conceção e desenvolvimento de dispositivos médicos. O SGQ garante que toda a documentação relacionada com a conceção e o desenvolvimento é controlada, gerida e documentada.
Design History File (DHF) um arquivo/registro importante, contendo toda a documentação relacionada ao projeto e desenvolvimento do dispositivo. O DHF fornece a evidência de que o projeto do dispositivo atende aos requisitos regulamentares.
O DHF deve conter documentação relacionada com os dados de entrada e saída do projeto, revisões do projeto, verificação do projeto, validação, alterações ao projeto e gestão do risco. Saiba mais sobre o DHF aqui.
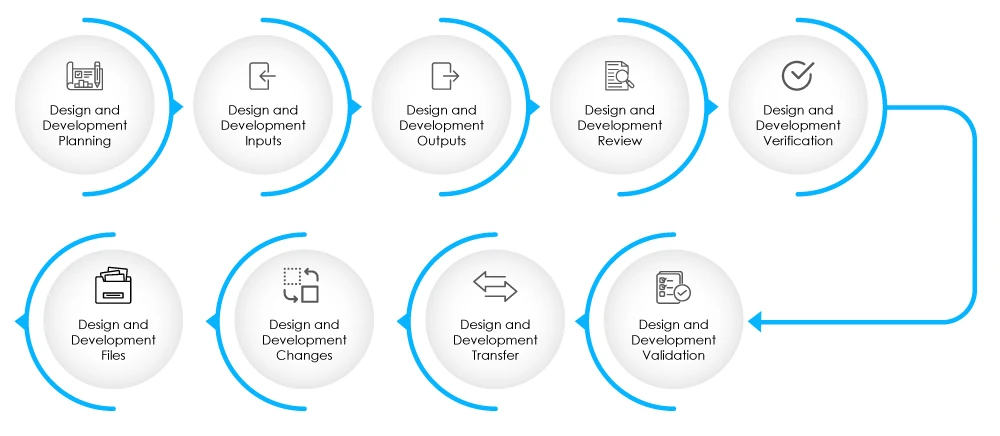
Fig 2-Estágios da fase de conceção e desenvolvimento
Melhores práticas para a fase de conceção e desenvolvimento
- Estabelecer uma abordagem estruturada: Desenvolver uma abordagem estruturada para o desenvolvimento e gestão de DHF que seja adaptada às necessidades específicas da sua organização. Esta abordagem deve incluir diretrizes, procedimentos e fluxos de trabalho claros para o desenvolvimento e gestão de DHF.
- Definir e documentar as entradas da conceção: Definir e documentar claramente os dados de conceção, incluindo os requisitos e especificações do dispositivo. Isto pode ajudar a garantir que o DHF é abrangente e completo.
- Gerir as alterações ao projeto: Implemente um processo robusto de gestão de alterações que inclua procedimentos para documentar, avaliar e aprovar alterações de conceção. Isto pode ajudar a garantir que as alterações são corretamente documentadas e avaliadas quanto ao seu impacto na segurança e eficácia do dispositivo.
- Assegurar a rastreabilidade: Desenvolver uma matriz de rastreabilidade que ligue os inputs da conceção aos outputs da conceção e garantir que todas as actividades de conceção e desenvolvimento são devidamente documentadas e registadas. Isto pode ajudar a garantir que a DHF é rastreável e que o processo de tomada de decisão está bem documentado.
- Equilibrar a inovação e a conformidade: Desenvolver uma cultura de inovação, assegurando simultaneamente o cumprimento dos requisitos de conformidade relacionados com as DHF, como os controlos de conceção e a gestão de riscos. Isto pode ser conseguido através do desenvolvimento de procedimentos e fluxos de trabalho que facilitem a inovação, garantindo simultaneamente o cumprimento dos requisitos regulamentares.
- Implementar o controlo de documentos: Implementar procedimentos de controlo de documentos que garantam que os documentos DHF são devidamente controlados, controlados por versão e acessíveis a pessoal autorizado. Isto pode ajudar a garantir que os documentos DHF estão seguros e que as alterações são devidamente documentadas e aprovadas.
- Formar a equipa: Assegurar que a equipa responsável pelo desenvolvimento e gestão da DHF tem formação adequada sobre os requisitos da DHF e possui os conhecimentos técnicos necessários para desenvolver o produto. Isto pode ser conseguido através de sessões de formação regulares, orientação e contratação de profissionais experientes com as competências e conhecimentos necessários.
Ao seguir estas boas práticas, a indústria de dispositivos médicos pode garantir a conformidade com os requisitos regulamentares, promover a segurança e a eficácia dos seus produtos e manter a sua vantagem competitiva no mercado.
Em conclusão, a implementação de um SGQ desde a fase de conceção e desenvolvimento é fundamental para o sucesso no sector altamente regulamentado dos dispositivos médicos. Mantendo registos sistemáticos e cumprindo os requisitos regulamentares, a indústria de dispositivos médicos pode garantir que está a fornecer produtos de alta qualidade e a manter a satisfação do cliente.
Na Freyr, oferecemos serviços de QMS para ajudar a indústria de dispositivos médicos a cumprir os requisitos regulamentares em todas as fases do ciclo de vida dos dispositivos médicos.Entre em contactocom os nossos especialistas em QMS e regulamentação para saber mais.









