
Um 510(k) ou uma notificação pré-comercialização é um pedido apresentado à Food and Drug Administration (FDAUS para demonstrar que o dispositivo a ser comercializado é seguro e eficaz, ou seja, substancialmente equivalente a um dispositivo comercializado legalmente ou a um dispositivo de referência. A seguir estão os três (03) tipos de 510(k) que um fabricante de dispositivos médicos pode apresentar:
- Tradicional
- Abreviado
- Especial 510(k)
Neste blog, examinaremos os casos em que submissão sua submissão para o segundo tipo, um 510(k) abreviado, de acordo com osFDA US .
Um 510(k) abreviado é utilizado para demonstrar equivalência substancial a uma norma reconhecida, controlo especial ou orientação utilizando uma Declaração de Conformidade (DoC). Numa submissão abreviada, os fabricantes demonstram equivalência substancial a normas reconhecidas com base na utilização de documentos de orientação ou DoCs, em vez de um dispositivo predicado, para facilitar a revisãoFDA US . Abaixo está o fluxograma para determinar a equivalência substancial para uma submissão abreviada 510(k).
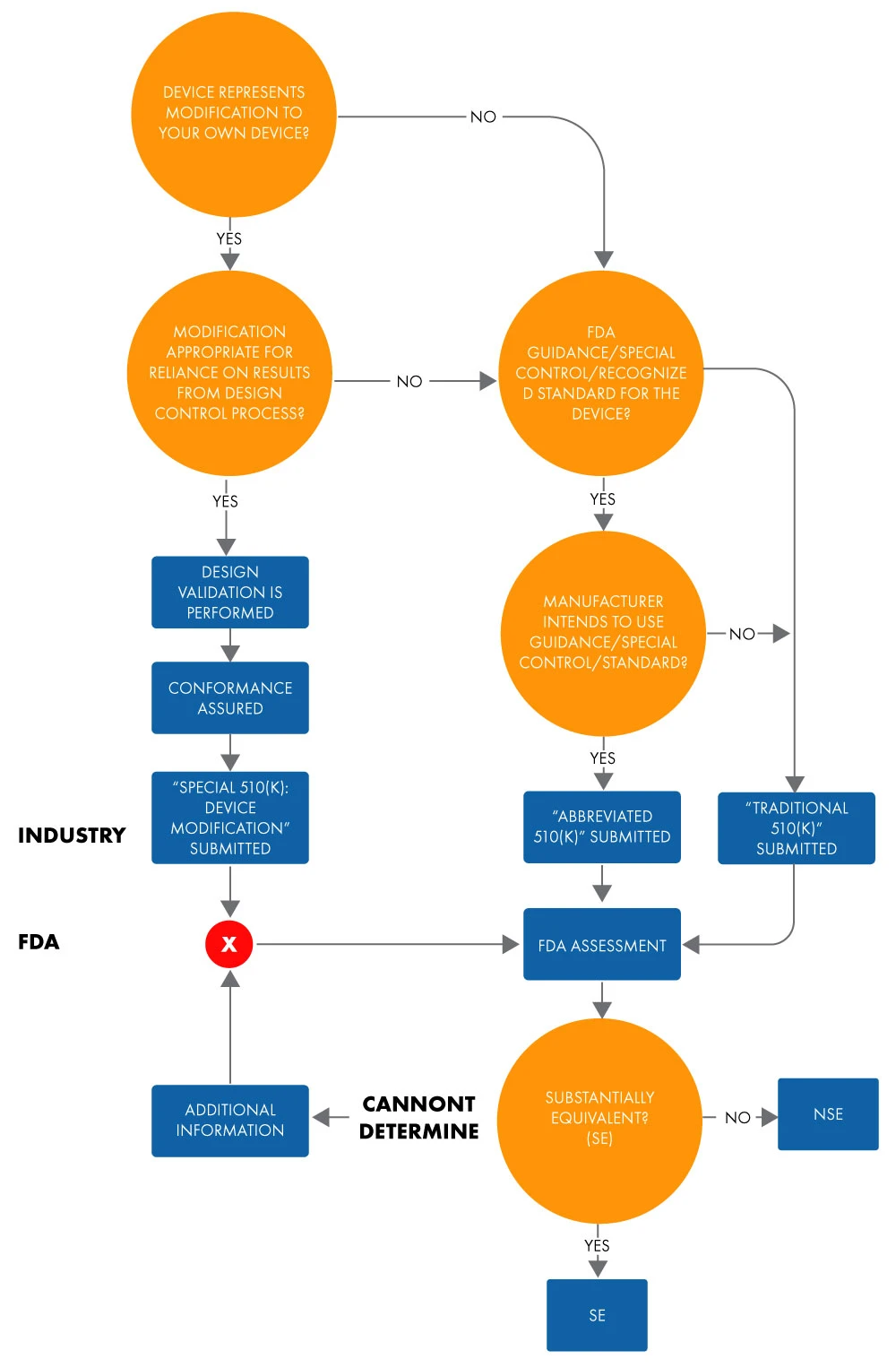
Figura 1: Intenção de comercializar um dispositivo através de 510(k)
O termo "abreviado" sugere que este tipo de processo de aprovação 510(k) é mais curto. No entanto, isto não é inteiramente verdade. Demora tanto tempo como uma aprovação 510(k) tradicional. O mesmo se aplica à documentação e aos custos. Além disso, o formato dos 510(k) tradicionais e abreviados, em termos de capítulos e estrutura, é semelhante.
Ao apresentar um pedido 510(k) abreviado, deve basear-se nos elementos identificados no CFR 21 807.87 (pedidos 510[k] tradicionais). Pode optar por apresentar um formulário 510(k) abreviado quando a apresentação se basear nos seguintes elementos
- DocumentosFDA : Aoenviar um 510(k) abreviado, deve incluir um relatório resumido que descreva a conformidade com o documento de orientação relevante e como ele foi utilizado durante o desenvolvimento e teste do dispositivo.
- Demonstração de conformidade com controlos especiais para o tipo de dispositivo: Devecumprir controlos especiais, tais como normas de desempenho, Vigilância Pós-Comercialização PMS), registos de pacientes, desenvolvimento e divulgação de diretrizes, recomendações, etc., que forneçam garantias razoáveis da segurança e eficácia do dispositivo. Uma submissão abreviada 510(k) que se baseia em um ou mais controlos especiais deve incluir o seguinte. Um relatório resumido que descreva a adesão aos controlos especiais e como eles foram usados durante o desenvolvimento e teste do dispositivo.
- A forma como os controlos especiais foram utilizados para abordar um risco ou uma questão específica.
- Informações que descrevam quaisquer desvios aos controlos específicos e as tentativas do fabricante para os cumprir.
- Norma(s) de consenso voluntária(s): É-lhe exigido que forneça um DoC à norma reconhecida para uma apresentação abreviada 510(k) que se baseie nela. Um DoC deve incluir o seguinte:
- O nome e endereço do requerente/patrocinador responsável pela Declaração de Conformidade.
- Pormenores da identificação do produto/dispositivo, incluindo códigos do produto, designação comercial do dispositivo, número do modelo e quaisquer outros dados únicos de identificação do produto específicos do DoC em questão.
- Uma declaração de conformidade.
- Uma lista de normas para as quais a DoC é aplicável, incluindo a(s) opção(ões) selecionada(s) para cada norma, caso exista(m).
- O númeroFDA US para cada norma.
- A data e o local de emissão da DoC.
- A assinatura, o nome impresso e a função do patrocinador responsável pela DoC.
- Quaisquer limitações à validade da declaração de conformidade (por exemplo, durante quanto tempo a declaração é válida, o que foi testado, concessões feitas sobre os resultados do teste, etc.)
Em conclusão, um 510(k) abreviado é uma forma útil para os fabricantes de dispositivos demonstrarem equivalência substancial a normas reconhecidas ou controlos especiais utilizando um DoC. Para se qualificarem para um 510(k) abreviado, os fabricantes de dispositivos devem fornecer um relatório resumido que explique a sua adesão aos documentos de orientação relevantes, demonstrar a conformidade com controlos especiais e fornecer DoCs para normas reconhecidas. É, no entanto, importante notar que o processo de aprovação, a documentação e o custo de um 510(k) abreviado são semelhantes aos de um 510(k) tradicional.
O seu dispositivo médico é elegível para uma submissão 510(k) abreviada? Para obter assistência no preenchimento da sua submissão 510(k) abreviada, reach como nossoespecialista em regulamentação. Mantenha-se informado! Mantenha-se em conformidade!









