
Der Internationale Rat für die Harmonisierung der technischen Anforderungen an Humanarzneimittel (ICH) ist eine internationale gemeinnützige Organisation, die sich um die Pflege einer aktuellen Datenbank bemüht, um Aufsichtsbehörden und Arzneimittelhersteller zusammenzubringen, um wissenschaftliche und technische Aspekte der Branche auf einer einzigen Plattform zu diskutieren. Das Medical Dictionary for Regulatory Activities (MedDRA), das sich im Besitz ICH befindet und von ICH entwickelt wurde, ist ein eigenständiges und standardisiertes Regulierungswörterbuch, das die nahtlose Kommunikation von Regulierungsinformationen auf der ganzen Welt erleichtert. Ebenso ist die Systematized Nomenclature of Medicine (SNOMED) International eine gemeinnützige Organisation, die Pionierarbeit im Bereich der klinischen Terminologie leistet und die weltweit umfassendste Terminologiedatenbank, die Systematized Nomenclature of Medicine – Clinical Terms (SNOMED CT), unterhält, die über 350.000 Begriffe aus den Bereichen Diagnose, Anzeichen und Symptome umfasst.
In einer 2009 veröffentlichten Studie wurde die Machbarkeit der Verwendung von SNOMED CT als Einstiegspunkt für die Kodierung von Arzneimittelnebenwirkungen und deren automatische Zuordnung zu MedDRA für Berichtszwecke und die Interoperabilität mit älteren Repositorien analysiert. In Anbetracht des Umfangs einer solchen Zusammenarbeit kündigten ICH SNOMED als gemeinsame Initiative die Veröffentlichung wichtiger neuer Zuordnungen im regulatorischen und klinischen Bereich an. Die Zusammenarbeit im Rahmen des Projekts WEB-RADR 2 führte zur Veröffentlichung von zwei (02) wichtigen Roadmaps (MedDRA zu SNOMED CT und SNOMED CT zu MedDRA), die sich an der Wiederholbarkeit der Begriffsverwendung und zusätzlichen wichtigen MedDRA-Begriffen zur Pharmakovigilanz orientieren, die von der Europäischen Arzneimittelagentur (EMA) identifiziert wurden. Zur Förderung der Arzneimittelsicherheit kann die Interoperabilität zwischen der Pharmakovigilanz-Datenbank (MedDRA) und elektronischen Gesundheitsakten (SNOMED CT) dazu beitragen, mögliche Nebenwirkungen zu identifizieren und gleichzeitig die Meldung unerwünschter Ereignisse zu aktivieren. Die durch solche Meldungen gesammelten Daten können für die Durchführung epidemiologischer Untersuchungen zur Patientendemografie nützlich sein. Wichtige Elemente im Zusammenhang mit der Meldung unerwünschter Ereignisse nach MedDRA könnten zur Zuordnung unerwünschter Arzneimittelwirkungen herangezogen werden und gleichzeitig „Hilfe bei der klinischen Entscheidungsfindung” bieten.
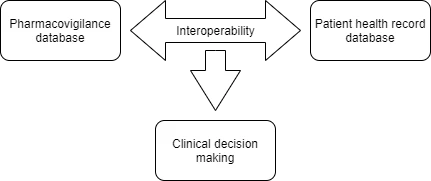
Die Produktionsversion der beiden Karten wird lizenzierten SNOMED CT- und MedDRA-Nutzern ab dem 30. April 2021 zur Verfügung gestellt und wird auf der Januar 2021-Version von SNOMED CT und der September 2020-Version von MedDRA basieren. Es wurde beschlossen, dass die Karten jährlich im April veröffentlicht werden sollen.
Um auf die Karten zuzugreifen:
- Lizenzierte MedDRA-Benutzer, besuchen Sie die Seite Downloads auf der MedDRA-Website
- Lizenzierte SNOMED CT-Benutzer besuchen SNOMED International
Die jüngsten Aktualisierungen hinsichtlich der etablierten Interoperabilität zwischen Pharmakovigilanz-Datenbank und Patientenakten mögen auf den ersten Blick komplex erscheinen. Die erfahrenen Regulatory-Experten von Freyr stehen Ihnen jedoch als zentraler Ansprechpartner zur Verfügung und bieten Ihnen technische Unterstützung in Bezug auf Patientenakten und erweiterte klinische Entscheidungsprozesse. Um die Qualität Ihrer Pharmakovigilanz-Anforderungen zu verbessern, bieten wir Ihnen Unterstützung in folgenden Bereichen: ICSR, aggregierte Berichte, Dienste für qualifizierte Personen, die für die Pharmakovigilanz verantwortlich sind (QPPV), US , Signalerkennung und -bewertung, Datenbankmigration, Abgleich unerwünschter Ereignisse und lokale Affiliate-Dienste und vieles mehr. Um mehr über end-to-end von Freyr zu erfahren, kontaktieren Sie uns jetzt! Bleiben Sie informiert. Bleiben Sie konform.









