Als die COVID-19-Pandemie im Jahr 2020 erstmals als globale Gesundheitskrise erkannt wurde, ergriffen die Gesundheitsbehörden weltweit innovative Maßnahmen, um bestmöglich darauf zu reagieren. Ebenso entwickelten Pharmaunternehmen mehrere Impfstoffe/Arzneimittel zum Wohle der Öffentlichkeit. Die Zulassung der Produkte erwies sich jedoch als recht schwierig. Um die Zulassung zu vereinfachen und gleichzeitig ihre Sicherheit, Qualität und Wirksamkeit zu gewährleisten, erteilten die Gesundheitsbehörden einigen Impfstoffen und relevanten Produkten eine Notfallzulassung (Emergency Use Authorization, EUA).
Es stellt sich die Frage, wie die Gesundheitsbehörden sicherstellen konnten, dass der Nutzen der genannten Produkte die Risiken überwiegt. Die Antwort liegt in der Anwendung der besten Praktiken der Pharmakovigilanz (PV).
Was ist Pharmakovigilanz?
PV ist definiert als eine Reihe wissenschaftlicher Aktivitäten zur Erkennung, Bewertung, zum Verständnis und zur Vorbeugung von unerwünschten Wirkungen und anderen drogenbezogenen Problemen. Im Folgenden werden die Funktionsweise und der Prozess der PV bildlich erläutert.
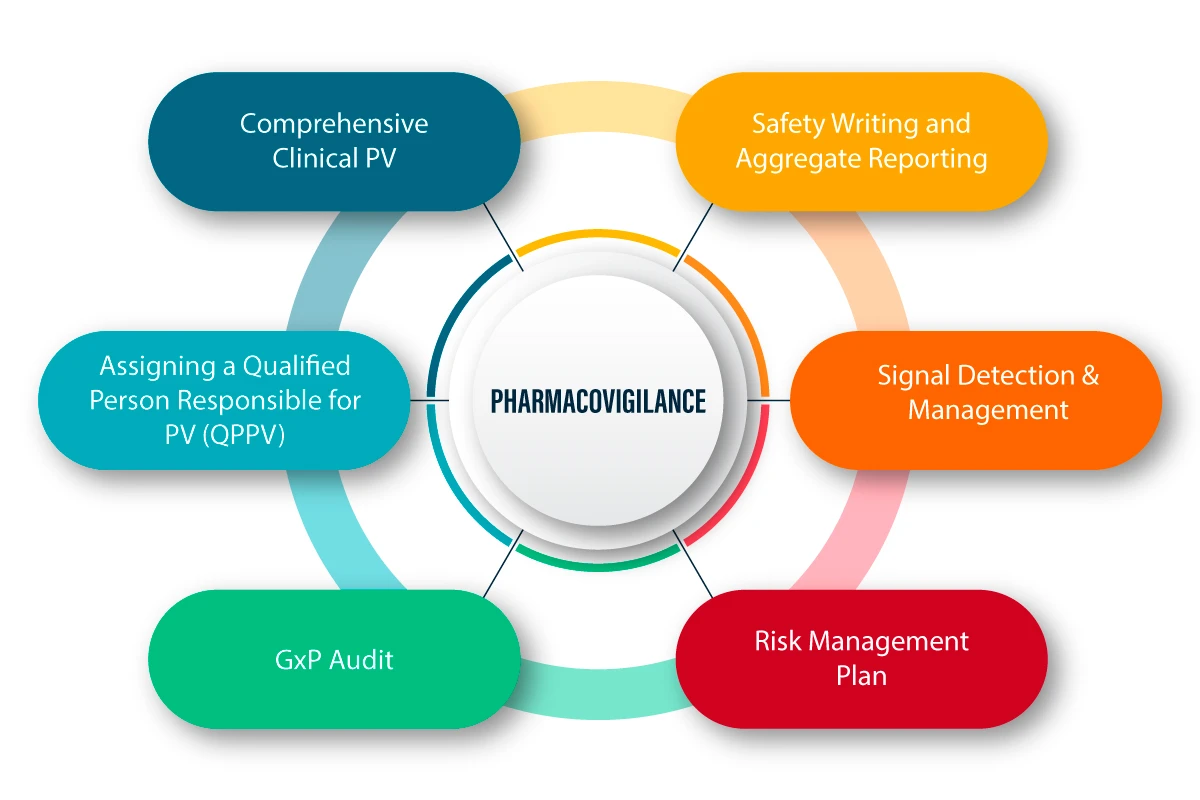
PV in der COVID-19-Pandemie
Als sich die COVID-19-Pandemie weltweit auszubreiten begann, mussten Impfstoffe und relevante Arzneimittel innerhalb eines begrenzten Zeitraums auf den Markt gebracht werden, wobei die erforderlichen Qualitätsstandards einzuhalten waren. In solchen Szenarien standen während der Entwicklungsphase von Arzneimitteln/Impfstoffen weniger Probanden für klinische Studien zur Verfügung, und der Prozess musste schneller als normal abgeschlossen werden. Dies könnte dazu führen, dass in der Phase nach der Zulassung bestimmte Nebenwirkungen auftreten.
Daher wurde das Nutzen-Risiko-Verhältnis von Impfstoffen/Arzneimitteln als vorrangig angesehen. Durch die zeitnahe Meldung von Nebenwirkungen und schädlichen Nebenwirkungen wurde die Wirksamkeit der Produkte in Echtzeit aufrechterhalten.
Einige der wichtigsten PV-Aktivitäten, die dazu beigetragen haben, die Sicherheit, Qualität und Wirksamkeit der genannten Produkte während der Pandemie aufrechtzuerhalten, sind die folgenden:
- Verabschiedung eines guten Risikomanagementplans
- Risikobewertung mit Hilfe der regelmäßigen aktualisierten Sicherheitsberichte (PSURs)
- Zusammenstellung der Expositionsdaten
- Sicherheitsstudien nach der Zulassung (PASS)
- Spontane Meldung vermuteter unerwünschter Wirkungen
- Wirksames Signalmanagement
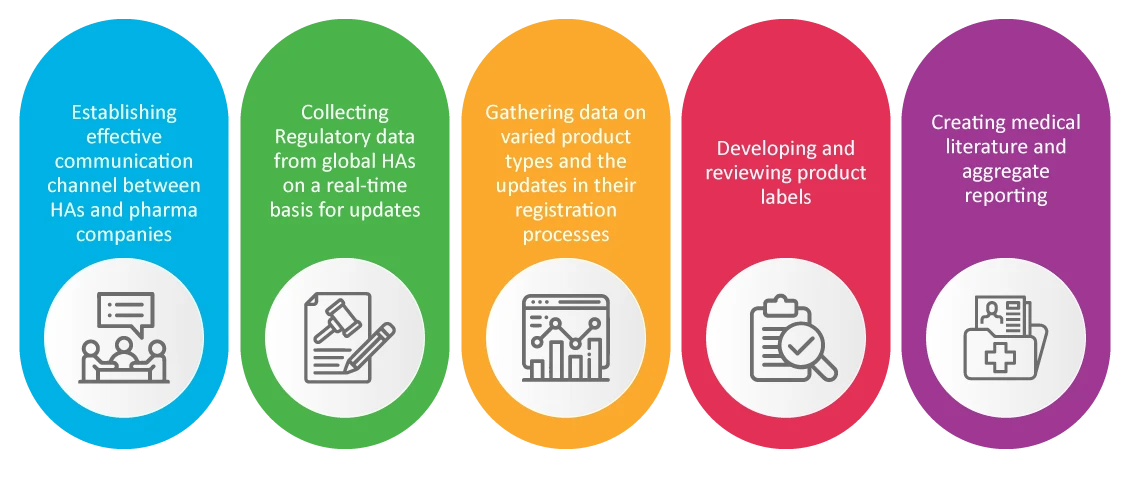
PV in der Zulassungsabteilung (RA)
Es ist allgemein bekannt, dass das Regulatory Affairs-Team eines Pharmaunternehmens für die Sicherheit und Zulassung neuer Produkte verantwortlich ist. RA kümmern sich um Pharmakovigilanz-Aktivitäten, die sich während der Pandemie als entscheidend erwiesen haben, wie zum Beispiel:
Schlussfolgerung
Zusammenfassend lässt sich sagen, dass PV dabei hilft, die Sicherheit eines Arzneimittels zu überwachen und zu dokumentieren. Mit maßgeschneiderten individuellen Fallstudienberichten (ICSR) wird es für Hersteller/Sponsoren einfacher, die jeweiligen Vorschriften der globalen Gesundheitsbehörden einzuhalten. Suchen Sie Unterstützung bei der Erstellung von ICSR? Wenden Sie sich an einen bewährten Experten für regulatorische Fragen, um die Einhaltung der Vorschriften sicherzustellen. Reach Freyr.









