
Die Austauschbarkeit mit einem biologischen Referenzprodukt ist ein entscheidender Schritt im Zulassungsverfahren für Biosimilars. Sie gewährleistet, dass ein Biosimilar das Referenzprodukt ohne nennenswertes Risiko einer verminderten Wirksamkeit oder erhöhter Sicherheitsbedenken ersetzen kann. Dieser Blogbeitrag versucht, die neuesten FDA zu den Überlegungen zur Erreichung der Austauschbarkeit sowie die besten Praktiken der Branche zur Erreichung regulatorischer Exzellenz zu verstehen.
Definition der Austauschbarkeit
Das Erreichen der Austauschbarkeit ist ein komplexer und strenger Prozess, der die Erfüllung strenger gesetzlicher Anforderungen erfordert. Die Herausforderung besteht darin, nachzuweisen, dass das Biosimilar dem Referenzprodukt nicht nur in Bezug auf Sicherheit und Wirksamkeit sondern auch die gleichen klinischen Ergebnisse bei einem bestimmten Patienten liefert. Werden diese Anforderungen nicht erfüllt, kann sich die Zulassung verzögern oder verweigern, was den Marktzugang und die Patientenversorgung beeinträchtigt.
Regulatorische Anforderungen an die Austauschbarkeit
Die FDA in ihren Leitfäden spezifische Kriterien für den Nachweis der Austauschbarkeit FDA . Zu diesen Kriterien gehören:
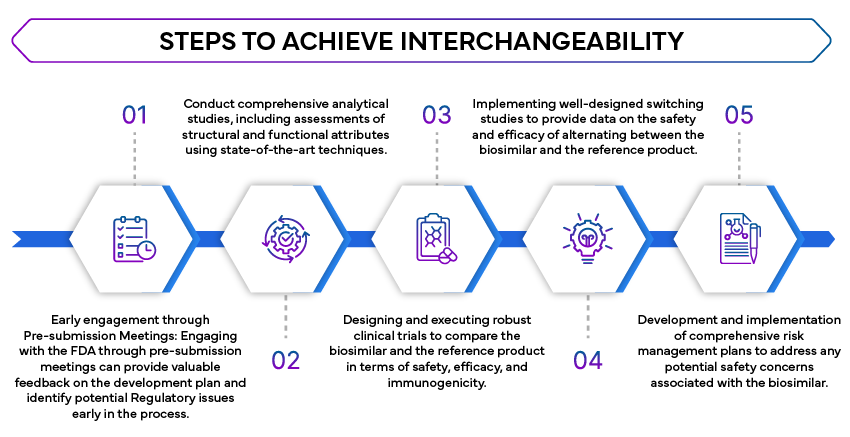
- Vergleichende analytische Studien: Es sind umfangreiche analytische Studien erforderlich, um nachzuweisen, dass das Biosimilar dem Referenzprodukt sehr ähnlich ist. Diese Studien bewerten die molekulare Struktur, Funktion und Zusammensetzung des Biosimilars.
- Klinische Studien: Klinische Studien sind erforderlich, um zu bestätigen, dass das Biosimilar keine klinisch bedeutsamen Unterschiede zum Referenzprodukt in Bezug auf Sicherheit, Reinheit und Wirksamkeit aufweist. Dazu gehören häufig vergleichende pharmakokinetische (PK) und pharmakodynamische (PD) Studien.
- Wechselstudien: Die FDA Wechselstudien, um die Auswirkungen des Wechsels zwischen dem Biosimilar und dem Referenzprodukt zu bewerten. Diese Studien sind entscheidend, um sicherzustellen, dass der Wechsel die Wirksamkeit oder Sicherheit der Behandlung nicht beeinträchtigt.
- Strategien zur Risikobewertung und -minderung (REMS): Falls zutreffend, müssen REMS angesprochen werden, um sicherzustellen, dass das Biosimilar ohne zusätzliche Sicherheitsbedenken austauschbar verwendet werden kann.
Strategische Schritte zur Verwirklichung der Austauschbarkeit
Die Rolle eines Regulierungspartners
Partnerschaften mit Zulassungsbehörden können die Wahrscheinlichkeit, dass eine Austauschbarkeit erreicht wird, deutlich erhöhen. Hier erfahren Sie, wie ein Regulierungspartner helfen kann:
- Fachkundige Beratung: Bietet fachkundige Beratung zu regulatorischen Anforderungen und Strategien zur Erfüllung FDA .
- Dokumentationsunterstützung: Assists in the preparation of high-quality submission documents that comply with Regulatory standards.
- Entwurf klinischer Studien: Unterstützt den Entwurf und die Durchführung von robusten klinischen Studien und Wechselstudien.
- HA-Interaktionen: Ermöglicht eine effektive Kommunikation mit den HA und sorgt für rechtzeitiges und konstruktives Feedback.
- Risikomanagement: Entwicklung umfassender Risikomanagement-Strategien zur Entschärfung potenzieller Sicherheitsbedenken.
Vorteile eines Regulierungspartners
| Vorteile | Beschreibung | |
| 1. | Fachwissen über regulatorische Anforderungen | Tiefgreifendes Verständnis der globalen rechtlichen Rahmenbedingungen und Anforderungen. |
| 2. | Rationalisierte Dokumentation | Sorgt für die korrekte und vorschriftsmäßige Erstellung der Dokumentation. |
| 3. | Effizienter Einreichungsprozess | Zeit- und Kostenersparnis durch effizientes Antragsmanagement. |
| 4. | Verbesserte Compliance | Minimiert das Risiko von Verzögerungen und Ablehnungen durch gründliche Einhaltung der Vorschriften. |
| 5. | Wirksames Risikomanagement | Proaktive Identifizierung und Abschwächung potenzieller Risiken. |
Zusammenfassung
Die Erreichung der Austauschbarkeit mit einem Referenzprodukt ist ein anspruchsvoller, aber wesentlicher Prozess für die erfolgreiche Zulassung von Biosimilars. Er erfordert ein umfassendes Verständnis der regulatorischen Anforderungen, eine sorgfältige Planung und solide klinische Daten. Die Zusammenarbeit mit einem erfahrenen Dienstleister für Zulassungsfragen kann die Erfolgschancen erheblich verbessern und sicherstellen, dass das Biosimilar die strengen Kriterien der Zulassungsbehörden erfüllt. Durch fachkundige Beratung, gründliche Dokumentation und strategisches Risikomanagement können Sponsoren den komplexen Weg zur Austauschbarkeit effektiver beschreiten.









