
In den letzten Jahren hat sich die Landschaft der regulatorischen Angelegenheiten erheblich verändert. Im Mittelpunkt dieses Wandels steht eine zunehmende Betonung der PatientenorientierungPatientenorientierung, wobei Gesundheitsbehörden (HA) weltweit die unschätzbare Rolle der Patienten bei der Entwicklung und Zulassung neuer Arzneimittel anerkennen. Diese Verschiebung ist nicht nur ein Trend, sondern eine grundlegende Neukonzeption unserer Herangehensweise an Zulassungsanträge und letztlich auch unserer Dienstleistungen für diejenigen, die am wichtigsten sind – den Patienten.
Das Problem:
Traditionell konzentrierten sich Zulassungsanträge in erster Linie auf die Erfüllung technischer und wissenschaftlicher Anforderungen, wobei die direkten Auswirkungen auf die Erfahrungen und Ergebnisse der Patienten oft übersehen wurden. Dieser Ansatz ist zwar gründlich, berücksichtigt jedoch manchmal nicht die Nuancen der Bedürfnisse und Präferenzen der Patienten sowie die tatsächliche Verwendung von Arzneimitteln. Infolgedessen gab es eine Diskrepanz zwischen den behördlichen Zulassungen und dem tatsächlichen Nutzen für die Patienten.
Patientenzentrierte Regulierungsansätze:
Die Gesundheitsbehörden, insbesondere die FDA EMA, haben erhebliche Fortschritte bei der Einbeziehung der Patientenperspektive in ihre Regulierungsrahmen erzielt.
Dieser Ansatz, bei dem der Patient im Mittelpunkt steht, wird in mehreren Schlüsselbereichen deutlich:
- Patient-Focused Drug Development (PFDD):
Das PFDD-Programm FDA ist eine bahnbrechende Initiative, die systematisch Patientenmeinungen sammelt, um die Arzneimittelentwicklung und regulatorische Entscheidungsfindung zu beeinflussen. Dieses Programm umfasst Patientengespräche, öffentliche Sitzungen und die Entwicklung von Leitfäden, um die Patientenbeteiligung während des gesamten Produktlebenszyklus zu verbessern. - Real-World Evidence (RWE):
Der Wert von Daten aus der realen Welt für das Verständnis der Leistung eines Produkts in verschiedenen Patientengruppen wird zunehmend anerkannt. Die Gesundheitsbehörden sind jetzt offener für die Berücksichtigung von RWE in Zulassungsanträgen, die einen umfassenderen Überblick über die Vorteile und Risiken eines Produkts bieten. - Von Patienten gemeldete Ergebnisse (PROs):
Die Einbeziehung von PROs in klinische Studien und Zulassungsanträge hat zunehmend an Bedeutung gewonnen. Diese Messwerte erfassen direkt die Erfahrungen der Patienten und liefern wertvolle Erkenntnisse über Symptome, Lebensqualität und Behandlungszufriedenheit. - Frühzeitiges Engagement und wissenschaftliche Beratung:
Die Gesundheitsbehörden ermutigen die Sponsoren, sich frühzeitig in den Entwicklungsprozess einzubringen und dabei häufig auch Patientenvertreter in diese Diskussionen einzubeziehen. Dieser frühzeitige Dialog hilft, die Entwicklungspläne auf die Bedürfnisse der Patienten und die Erwartungen der Behörden abzustimmen. - Einbeziehung von Patienten in Nutzen-Risiko-Bewertungen:
Sowohl die FDA EMA Rahmenwerke entwickelt, um die Perspektive der Patienten in Nutzen-Risiko-Bewertungen einzubeziehen und sicherzustellen, dass regulatorische Entscheidungen die für Patienten wichtigsten Aspekte widerspiegeln.
Tabelle: Wichtige patientenzentrierte Initiativen der wichtigsten Gesundheitsbehörden
| Gesundheitsbehörde | Initiative | Beschreibung |
|---|---|---|
| FDA | Patientenorientierte Medikamentenentwicklung (PFDD) | Systematischer Ansatz zur Erfassung von Patientenbeiträgen |
| EMA | Arbeitsgruppe "Patienten und Verbraucher" (PCWP) | Forum für den Dialog mit Patienten- und Verbraucherorganisationen |
| MHRA | Einbindung von Patienten und Öffentlichkeit | Strategie zur Einbeziehung der Patienten in die Regulierungsprozesse |
| Health Canada | Kanadischer Rahmen für das Engagement im Bereich Arzneimittel und Gesundheitsprodukte | Stärkere Einbeziehung der Patienten in die Regulierungsaktivitäten |
Die Rolle der Regulierungsdienstleister:
In diesem sich wandelnden Umfeld ist die Rolle von Fachleuten und Partnern im Bereich Regulatory Affairs wichtiger denn je. Sie fungieren als Brücke zwischen Sponsoren, Gesundheitsbehörden und Patienten und stellen sicher, dass die Zulassungsstrategien mit patientenzentrierten Ansätzen übereinstimmen.
Zu den wichtigsten Aufgaben gehören:
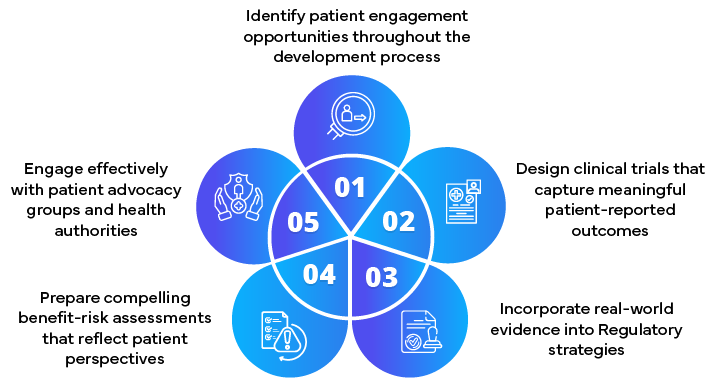
- Entwicklung von Strategien zur Einbeziehung von Patienten
- Einbeziehung von Patientenbeiträgen in Zulassungsanträge
- Beratung bei der Erhebung und Präsentation von patientenbezogenen Daten
- Erleichterung einer frühzeitigen Zusammenarbeit mit den Gesundheitsbehörden
- Immer auf dem Laufenden mit den sich entwickelnden patientenzentrierten gesetzlichen Anforderungen
Rolle der Regulierungspartner bei der Erreichung patientenorientierter Einreichungen
Zusammenfassung:
Der Wandel hin zu einer patientenzentrierten Zulassungspraxis bietet eine große Chance, medizinische Produkte zu entwickeln und zuzulassen, die wirklich den Bedürfnissen der Patienten entsprechen. Mit diesem Ansatz können Sponsoren nicht nur die Zulassungswege effizienter gestalten, sondern auch Produkte liefern, die das Leben der Patienten entscheidend verbessern. Da die Gesundheitsbehörden ihre patientenorientierten Ansätze immer weiter verfeinern, wird das Fachwissen von Dienstleistern oder Partnern im Bereich der Regulierung von unschätzbarem Wert sein, wenn es darum geht, sicherzustellen, dass die eingereichten Anträge nicht nur die technischen Anforderungen erfüllen, sondern auch den Erfahrungen und Prioritäten der Patienten gerecht werden.
In dieser neuen era Regulatory Affairsist es nicht nur gute Praxis, die Patienten an die erste Stelle zu setzen – es ist der Schlüssel zum Erfolg.









