
Wir nähern uns nun dem Jahr 2024. Fachleute aus dem Bereich Regulatory Affairs stehen an der Spitze spannender Innovationen und herausfordernder Trends, die die Entwicklung, Zulassung und Überwachung von Arzneimitteln, Medizinprodukten und biotechnologischen Produkten neu gestalten. Dieser Blog befasst sich mit den neuesten Entwicklungen im Bereich Regulatory Affairs und wie sie die Branche verändern.
Darüber hinaus hat der rasante Fortschritt in Wissenschaft und Technologie in Verbindung mit den sich ändernden Erwartungen der Patienten und den globalen gesundheitlichen Herausforderungen ein komplexes regulatorisches Umfeld geschaffen. Traditionelle Ansätze in der Zulassungspolitik haben Schwierigkeiten, mit Innovationen wie künstlicher Intelligenz, realitätsnaher Evidenz und personalisierter Medizin Schritt zu halten. Sowohl die Zulassungsbehörden als auch die Biowissenschaftsunternehmen müssen sich mit der Frage auseinandersetzen, wie sie die Sicherheit der Patienten und die Wirksamkeit der Produkte gewährleisten und gleichzeitig Innovationen fördern und den Marktzugang beschleunigen können.
Neue RA und regulatorische Innovationen:
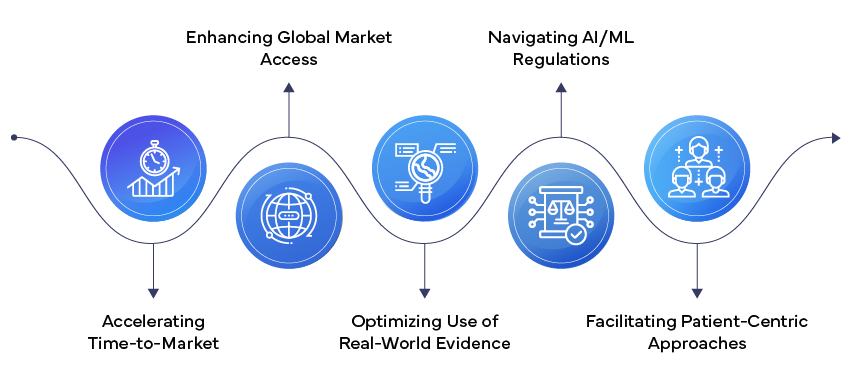
- Künstliche Intelligenz und Machine Learning: KI und ML den Bereich Regulatory Affairs, von der prädiktiven Modellierung für die Gestaltung klinischer Studien bis hin zur automatisierten Erkennung unerwünschter Ereignisse. Der kürzlich FDA vorgeschlagene Rahmen fürML Software als Medizinprodukt (SaMD) signalisiert eine Verlagerung hin zu adaptiveren regulatorischen Ansätzen für diese sich rasch entwickelnden Technologien.
- Integration von Real-World Evidence (RWE): Regulierungsbehördenakzeptieren zunehmend RWE zur Unterstützung ihrer Entscheidungsfindung. Dieser Trend ermöglicht schnellere Zulassungen und eine umfassendere Überwachung nach dem Inverkehrbringen. Der 21st Century Cures Act in den US ein wichtiger Impulsgeber für die Förderung der Verwendung von RWE in Zulassungsanträgen.
- Patientenzentrierte Regulierungsansätze: Die Einbeziehung der Patientenperspektive in den Zulassungsprozess gewinnt zunehmend an Bedeutung. Von Patienten berichtete Ergebnisse und Informationen über Patientenpräferenzen werden zu einem integralen Bestandteil von Zulassungsanträgen und spiegeln eine Verlagerung hin zu stärker patientenorientierten Arzneimittelentwicklungs- und -zulassungsverfahren wider.
- Beschleunigte Zulassungsverfahren: Die Aufsichtsbehörden führen beschleunigte Zulassungsverfahren ein und verfeinern diese, um den Zugang zu innovativen Therapien zu beschleunigen, insbesondere für seltene Krankheiten und ungedeckte medizinische Bedürfnisse. Die Einstufung als „Breakthrough Therapy” FDA und das PRIME-Programm (PRIority MEdicines) EMA sind Beispiele für diesen Trend.
- Globale Harmonisierung der Regulierung: Initiativenwie der Internationale Rat für Harmonisierung (ICH) treiben eine stärkere Angleichung der regulatorischen Anforderungen in verschiedenen Regionen voran, erleichtern die gleichzeitige Einreichung von Anträgen weltweit und reduzieren den regulatorischen Aufwand.
- Regulierung im Bereich digitale Gesundheit: DerAufstieg digitaler Gesundheitstechnologien, darunter mobile medizinische Apps und tragbare Geräte, veranlasst die Regulierungsbehörden dazu, neue Rahmenbedingungen für die Bewertung dieser Produkte zu entwickeln. Das Digital Health Center of Excellence FDA steht an der Spitze dieser sich wandelnden Regulierungslandschaft.
Tabelle: Vergleich zwischen traditionellen und innovativen Regulierungsansätzen
| Aspekt | Traditioneller Ansatz | Innovativer Ansatz |
|---|---|---|
| Datenquellen | Vor allem klinische Versuche | Klinische Studien + Erkenntnisse aus der Praxis |
| Überprüfungsprozess | Linear, schrittweise | Anpassungsfähig, kontinuierlich |
| Patienten-Input | Begrenzt | Integraler Bestandteil der Entwicklung |
| Technologieeinsatz | Grundlegende Datenanalyse | ML Analytik |
| Zulassungspfade | Standardpfade | Mehrere beschleunigte Optionen |
| Globale Strategie | Regionale Besonderheiten | Harmonisierter globaler Ansatz |
Die Rolle der Regulierungsexperten:
In diesem sich schnell entwickelnden Umfeld spielen Regulierungsexperten eine entscheidende Rolle, wenn es darum geht, Life-Science-Unternehmen bei der Bewältigung komplexer Herausforderungen zu unterstützen und neue Chancen zu nutzen.
Zu den wichtigsten von ihnen angebotenen Dienstleistungen gehören:
- Strategische Regulierungsplanung im Einklang mit innovativen Entwicklungsansätzen
- Fachwissen im Bereich der Nutzung vonML regulatorische Informationen und Einreichungen
- Leitlinien zur Integration von RWE in Regulierungsstrategien
- Unterstützung bei der Einbindung von Patienten und der Berücksichtigung von Patientenperspektiven
- Navigation von beschleunigten Zulassungswegen und globalen Harmonisierungsinitiativen
- Fachwissen über Vorschriften im Bereich der digitalen Gesundheit und neue technologische Rahmenbedingungen
Vorteile eines Regulierungsexperten
Die Landschaft der Zulassungsangelegenheiten befindet sich in einem tiefgreifenden Wandel, der von technologischen Fortschritten, patientenorientierten Ansätzen und der Notwendigkeit effizienterer Arzneimittelentwicklungsprozesse angetrieben wird. In dem Maße, wie die Branche diese neuen Trends und Innovationen aufgreift, wird die Rolle der Zulassungsexperten immer wichtiger. Indem sie diesen Trends immer einen Schritt voraus sind und das Fachwissen ihrer Partner in der Zulassungsabteilung nutzen, können Life-Sciences-Unternehmen diese komplexe Landschaft effektiver navigieren und innovative Therapien schneller zu den Patienten bringen, während sie gleichzeitig die höchsten Sicherheits- und Wirksamkeitsstandards einhalten. In der Zukunft geht es bei den regulatorischen Angelegenheiten nicht nur um die Einhaltung von Vorschriften, sondern auch um die Förderung von Innovationen und die Verbesserung der globalen Gesundheitsversorgung. Klicken Sie hier, um mehr über Vorschriften und Compliance-Praktiken zu erfahren.









