
Mit Wirkung vom 31. Januar 2022 ist die neue Arzneimittelverordnung der Europäischen Union (EU) über klinische Prüfungen (Clinical Trials Regulation, CTR) verbindlich geworden und hat die Richtlinie 2001/20/EG über klinische Prüfungen aufgehoben. Die Verordnung harmonisiert die Protokolle für die Bewertung und Überwachung klinischer Prüfungen in der gesamten EU. Die Richtlinien wurden überarbeitet, um einen einheitlichen Ansatz für die klinische Forschung zu fördern und gleichzeitig die Sicherheit der Teilnehmer an klinischen Prüfungen und eine verstärkte Offenlegung gegenüber der Öffentlichkeit zu gewährleisten.
Mit der Verordnung wird ein neues zweiteiliges Bewertungssystem für alle klinischen Prüfungen in der EU eingeführt. Teil I besteht aus einer wissenschaftlichen Bewertung der wichtigsten Unterlagen zur klinischen Prüfung und Teil II aus einer ethischen Bewertung der Dokumentation auf nationaler Ebene. Im Anschluss an diese zweiteilige Bewertung wird jeder Mitgliedstaat eine einheitliche Entscheidung über die Prüfung treffen und den Sponsor über das Informationssystem für klinische Prüfungen informieren.
Übergangsfristen für neue Antragsteller
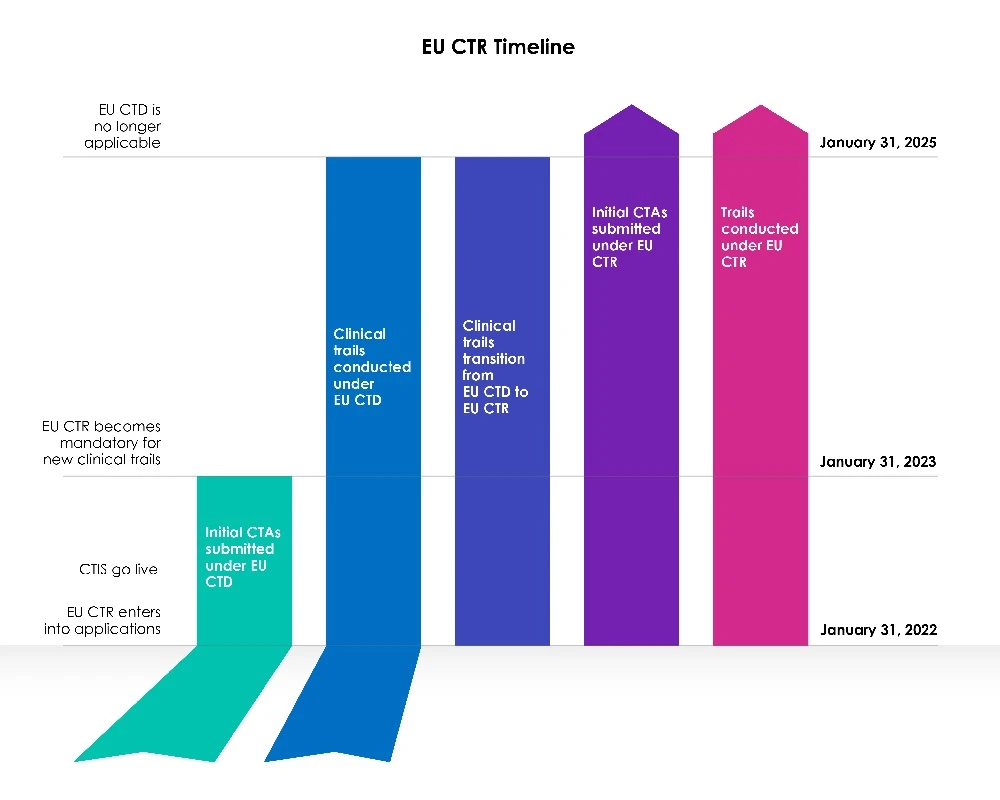
Mit dem Starttermin CTIS EU CTIS begann eine dreijährige (03) Übergangsphase.
Jahr 1 (31. Januar 2022 bis 30. Januar 2023):
Die Richtlinie 2001/20/EG der Europäischen Union (EU) über klinische Prüfungen (EU-CTD) regelt seit 2004 klinische Prüfungen in der EU. Sie zielte darauf ab, die Vorschriften zu vereinheitlichen und die Patientensicherheit bei klinischen Prüfungen erheblich zu verbessern. In der Praxis hatte sie jedoch unbeabsichtigte Folgen. Im ersten Jahr nach der CTIS konnten die Sponsoren wählen, ob sie einen neuen Antrag auf Durchführung einer klinischen Prüfung (CTA) im Rahmen des Clinical Trial Information System (CTIS) gemäß der Richtlinie über klinische Prüfungen (CTD: Richtlinie 2001/20/EG) stellen oder CTIS der geltenden Rechtsvorschrift, der Verordnung (EU) Nr. 536/2014 über klinische Prüfungen, nutzen wollten.
Beide Ideen waren realisierbar, und die Befürworter hatten die Möglichkeit, sich für einen der beiden Vorschläge zu entscheiden.
Die Mitglieder waren bereit, das Informationssystem für klinische Prüfungen (CTIS) zu nutzen, und nahmen am ersten Tag des CTIS Anträge gemäß der neuen Rechtsvorschrift, der Verordnung über klinische Prüfungen (EU CTR), entgegen.
Jahre 2 und 3 (31. Januar 2023 bis 31. Januar 2025):
Ab dem 31. Januar 2023 müssen alle neuen CT-Anträge CTIS der neuen Gesetzgebung (CTR) über das CTIS eingereicht werden.
Neue CT-Anträge dürfen gemäß der Richtlinie über klinische Prüfungen (CTD) nicht in EudraCT eingereicht werden. Die EU-Richtlinie über klinische Prüfungen lässt Member States 31. Januar 2023 keine Aufnahme neuer Member States mehr zu. Im Rahmen der CTD durchgeführte Prüfungen müssen zunächst umgestellt werden, danach kann ein zusätzlicher Antrag für die betroffenen Mitgliedstaaten über EU CTIS eingereicht werden.
Für bereits existierende Antragsteller
CT-Anträge, die vor dem 30. Januar 2023 im Rahmen der alten Gesetzgebung (CTD) unter Verwendung von EudraCT eingereicht wurden, dürfen bis zum Abschluss gemäß dieser Richtlinie (CTD: Richtlinie 2001/20/EG) bis zum 30. Januar 2025 weiterlaufen. Die Verfahren werden unverändert bleiben, und die Sponsoren werden in der Lage sein, wesentliche Änderungen und Mitteilungen über das Ende der Prüfung einzureichen, wie in der Verordnung vorgesehen. EudraCT wird während der Übergangszeit aktiv bleiben, damit diese Prüfungen fortgesetzt werden können.
Es ist jedoch wichtig zu beachten, dass die Anträge für den Übergang jederzeit während der drei (03) Jahre dauernden Übergangszeit eingereicht werden können, und die Sponsoren werden ermutigt, den Prozess früh genug in der Übergangszeit abzuschließen, um die Kontinuität der klinischen Prüfung in der EU über den 30. Januar 2025 hinaus zu gewährleisten, unter Berücksichtigung der gesetzlichen Feiertage und der zwei (02) Wochen langen Winterpause.
Nicht übertragbare Versuche
- Verfahren, die entweder bereits abgeschlossen sind oder kurz vor Ablauf derEEA derEEA abgeschlossen werden, dürfen nicht übertragen werden.
- Wenn in allenEEA eine Mitteilung über das Ende der Prüfung vorliegt, das weltweite Ende der Prüfung jedoch noch nicht gemeldet wurde, sollte die Studie nicht übertragen werden. Gemäß der Richtlinie sollten das weltweite Ende der Prüfung und die zusammengefassten Ergebnisse der Prüfung über EudraCT veröffentlicht werden.
- Prüfungen, die vor der Umsetzung der Richtlinie 2001/20/EG begonnen wurden, kommen nicht in den Genuss eines solchen Übergangsverfahrens. Wenn es sich um interventionelle Prüfungen handelt, die nach Ablauf der CTR-Übergangsphase weitergeführt werden müssen, muss eine neue CT-Anmeldung im Rahmen des CTR ausgestellt werden.
- Pädiatrische Studien, die außerhalb derEEA durchgeführt wurden, für dieEEA eine EudraCT-Nummer vergeben wurde, sollten ebenfalls nicht umgewandelt werden.
- Prüfungen, die nach Ablauf des Übergangszeitraums unterbrochen wurden, können nicht mehr weitergeführt werden. Die Wiederaufnahme der Prüfung würde unter diesen Umständen die Einreichung eines neuen Antrags nach dem CTR durch die CT-Anwendung erfordern.
CTIS EMA technische Updates von der EMA , um seine Funktionen und Funktionalitäten zu verbessern. Bei größeren Änderungen am CTIS EMA die EMA Release Notes, in denen die Änderungen am System beschrieben werden. Updates können Verbesserungen bestehender Funktionen und Funktionalitäten, die Hinzufügung neuer Funktionen sowie funktionale und technische Verbesserungen umfassen. Ein erfahrener Partner im Bereich Regulatory Affairs kann potenzielle Herausforderungen angehen und Sponsoren im Rahmen ihrer klinischen Entwicklungsstrategien bei der Umstellung bestehender und geplanter Studien unterstützen. Klicken Sie hier, um mehr über das CTIS die Expertise Freyrin diesem Bereich zu erfahren: https://regulatoryaffairs.freyrsolutions.com/clinical-trial-applications-ctas.









