
DieUS -amerikanische ArzneimittelbehördeFDA and DrugFDA) veröffentlichte im Dezember 2022 eine Leitlinie, eine Überarbeitung der Leitlinie mit dem Titel „Failure to Response to an ANDA Response Letter (CRL) Within the Regulatory Timeframe Guidance for Industry” (Leitlinie für die Industrie zur Nichtbeantwortung eines ANDA-Complete-Response-Letter (CRL) innerhalb der vorgeschriebenen Frist) vom Juli 2022. Sie soll Antragstellern von verkürzten Zulassungsanträgen für neue Arzneimittel (Abbreviated New Drug Applications, ANDAs) dienen, die gemäß Abschnitt 505(j) des Federal Food, Drug, and Cosmetic Act (FD&C Act) (21 U.S.C. 355(j)) eingereicht werden. Eine vollständige und relevante Antwort auf einen CRL ist für die Zulassung des Generikums von entscheidender Bedeutung. Der Leitfaden enthält Empfehlungen zu den Auswirkungen des Erhalts eines CRL und zu den Maßnahmen, die FDA ergreifen FDA , wenn der CRL nicht innerhalb der festgelegten Frist beantwortet wird.
Die FDA sicherstellen, dass die zugelassenen Generika die Standards hinsichtlich Sicherheit, Qualität, Wirksamkeit und Erschwinglichkeit erfüllen. Wenn der ANDA den FDA Anforderungen FDA ANDA , wird dem Antragsteller ein CRL zugesandt, in dem die bei der Bewertung festgestellten Mängel aufgeführt sind.
Es folgt eine bildliche Beschreibung dessen, was ein Antragsteller innerhalb eines Jahres nach Erhalt des GRL tun kann:
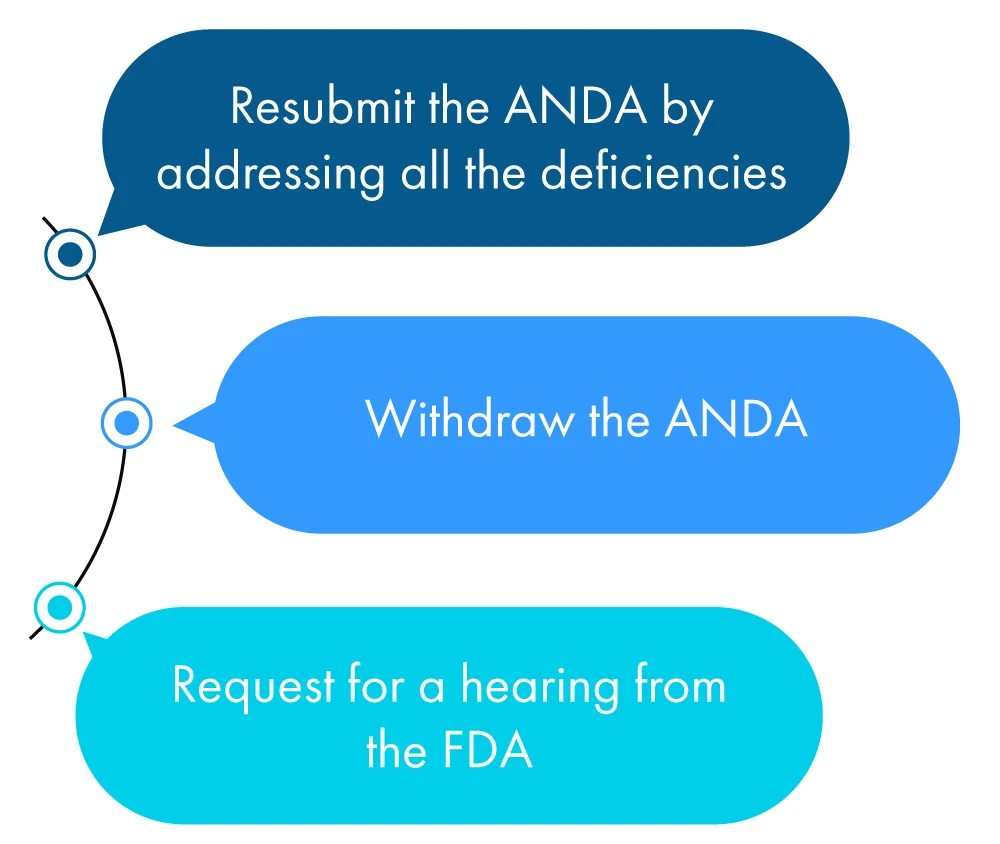
Wenn der Antragsteller keine der oben genannten Maßnahmen ergreift, FDA die FDA dies als Antrag auf Rücknahme des ANDA , der Antragsteller hat eine Fristverlängerung beantragt, um alle in der CRL genannten Unstimmigkeiten zu überprüfen.
Was geschieht nach einem (01) Jahr nach Ausstellung des GRL?
Die FDA eine schriftliche Benachrichtigung, dass der Antragsteller ab dem Datum der Benachrichtigung dreißig (30) Tage Zeit hat, um Folgendes zu tun:
- Begründen Sie, warum die ANDA nicht zurückgezogen werden ANDA
- Antrag auf Fristverlängerung zur Behebung aller im GRL genannten Mängel
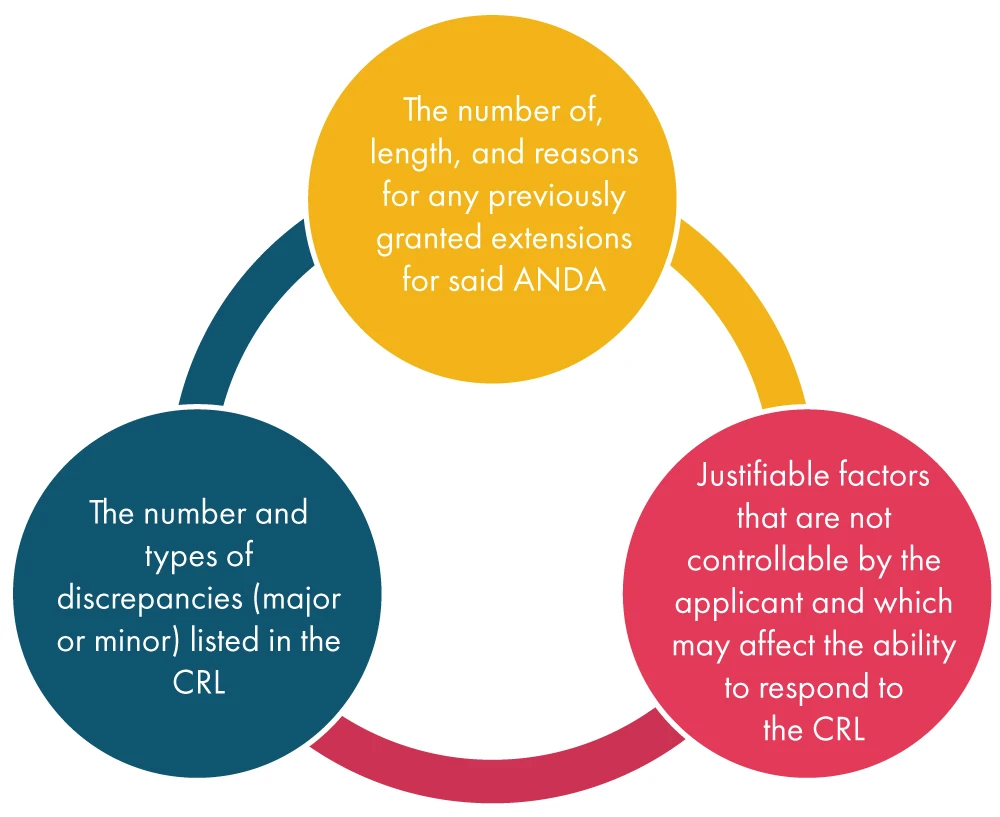
Sobald die FDA einen Antrag auf Verlängerung vom Antragsteller FDA , berücksichtigt sie verschiedene Faktoren, wie unten aufgeführt, und entscheidet anschließend über den Antrag:
Was ist ein Änderungsantrag?
Der Antragsteller muss einen Antrag auf Verlängerung der Frist für die Beantwortung einer CRL durch eine Änderung einreichen. Die FDA eine Änderung je nach ihrer Auswirkung auf das Zulassungsverfahren als größere oder geringfügige Änderung FDA .
Wichtige FDA , die Antragsteller beachten sollten:
- Die FDA eine geringfügige Änderung als wesentliche Änderung FDA , wenn die Änderung nach Ablauf eines Jahres nach Erhalt des CRL eingereicht wird, es sei denn, die ANDA ein Produkt, das gemäß Abschnitt 506E des FD&C Act (21 U.S.C. 356e) steht oder Gegenstand einer Reaktion auf einen vom US gemäß Abschnitt 319 des Public Health Service Act (42 U.S.C. 247d) ausgerufenen Gesundheitsnotstand ist oder zum Zeitpunkt der Einreichung voraussichtlich denselben Kriterien unterliegt, die für eine solche Erklärung gelten.
- Wenn der Antragsteller die in der CRL aufgeführten Unstimmigkeiten nicht innerhalb der von der FDA gewährten Verlängerungsfrist behebt, kann die FDA den Rückzug des ANDA in Betracht ziehen.
- Wenn der Antragsteller mehr als die dreißig (30) Tage Verlängerungsfrist benötigt, kann er eine weitere Verlängerung beantragen. Die Änderung muss dann neue Informationen enthalten, anhand derer die FDA ob die Verlängerung gewährt werden kann oder nicht.
Die Erlangung einer CRL von der FDA für ANDA eine ziemliche Herausforderung darstellen. Von der Behebung der Unstimmigkeiten bis hin zur Angabe der richtigen Gründe/Informationen für eine Verlängerung müssen alle relevanten Anforderungen erfüllt sein, um eine schnellere Zulassung des Arzneimittels zu gewährleisten. Freyr ist ein bewährter Experte für regulatorische Fragen mit umfassenden Kenntnissen im Umgang mit CRLs und der Sicherstellung der Einhaltung FDA . Kontaktieren Sie uns jetzt für eine end-to-end Unterstützung bei ANDA .









