Radiopharmazeutika sind Arzneimittel, die Radioisotope enthalten und als Diagnostika und Therapeutika eingesetzt werden. Sie zielen auf bestimmte Organe, Gewebe oder Zellen im menschlichen Körper ab. Diese Arzneimittel können oral, intravenös oder interstitiell verabreicht werden und bilden einen Teilbereich der Strahlentherapie. Für die Vermarktung von Radiopharmazeutika gelten strenge Vorschriften, da sie nur von Fachleuten mit Spezialisierung auf Nuklearmedizin verabreicht werden dürfen. Aufgrund ihrer Fähigkeit, bestimmte medizinische Probleme zu diagnostizieren oder Krankheiten wie Krebs zu behandeln, bieten sie jedoch immense Möglichkeiten. Der weltweite Markt für Radiopharmazeutika erreichte bis 2022 einen Wert von etwa US,9 Milliarden US und wird bis 2030 voraussichtlich 11,93 MilliardenUS reach , was einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 11,76 % entspricht.
Pharmazeutische Unternehmen aus aller Welt versuchen, sich einen Anteil am Markt für Radiopharmazeutika zu sichern, darunter auch solche aus Kanada. Health Canada HC), die kanadische Health Authority (HA), ist bekannt für ihre Bemühungen, der Öffentlichkeit hochwertige Gesundheitsdienstleistungen zur Verfügung zu stellen. Es gelten strenge Richtlinien/Vorschriften, um die Sicherheit der Patienten an erster Stelle zu gewährleisten. Hersteller/Sponsoren, die in den kanadischen Markt für Radiopharmazeutika eintreten möchten, müssen die von HC vorgegebenen Vorschriften verstehen und entsprechend eine ideale Einreichungsstrategie entwickeln, um eine schnellere Marktzulassung zu erhalten.
Der regulatorische Fahrplan für die Einreichung von Radiopharmazeutika in Kanada
Alle in Kanada vermarkteten Arzneimittel müssen dem Lebensmittel- und Arzneimittelgesetz (FDA andFDA) und den Lebensmittel- und Arzneimittelvorschriften (Food and Drugs Regulations, FDR) entsprechen. Radiopharmazeutika sind in Anhang C des FDA aufgeführt. Die Direktion für Biologika und Gentherapien (Biologics and Genetic Therapies Directorate, BGTD) des Gesundheitsministeriums (Health Canada, HC) regelt die Marktzulassung dieser Produkte. Sie werden für die Anwendung am Menschen zugelassen, wenn die Sicherheit, Wirksamkeit und Qualität der eingereichten Radiopharmazeutika zufriedenstellend bewertet wurden.
HC ist offizielles Mitglied des Internationalen Rates zur Harmonisierung der technischen Anforderungen an Humanarzneimittel (ICH). Es hat die ICH übernommen, die sich auf Qualität, Sicherheit, Wirksamkeit und multidisziplinäre Themen beziehen. Die Liste dieser Dokumente steht auf der HC-Website zur Verfügung und kann von den Sponsoren eingesehen werden.
Zusätzlich zu den oben genannten Dokumenten us die Leitlinie für die Industrie: Verwaltung von Arzneimittelanträgen (Leitfaden), die zuletzt am 2. August 2022 aktualisiert wurde, Einblicke in die Sichtweise von HC bei der Bewertung der von Sponsoren eingereichten Informationen zu Radiopharmazeutika. Die folgende Tabelle (Abbildung 1) gibt einen Überblick über die in dem Leitfaden behandelten Themen.
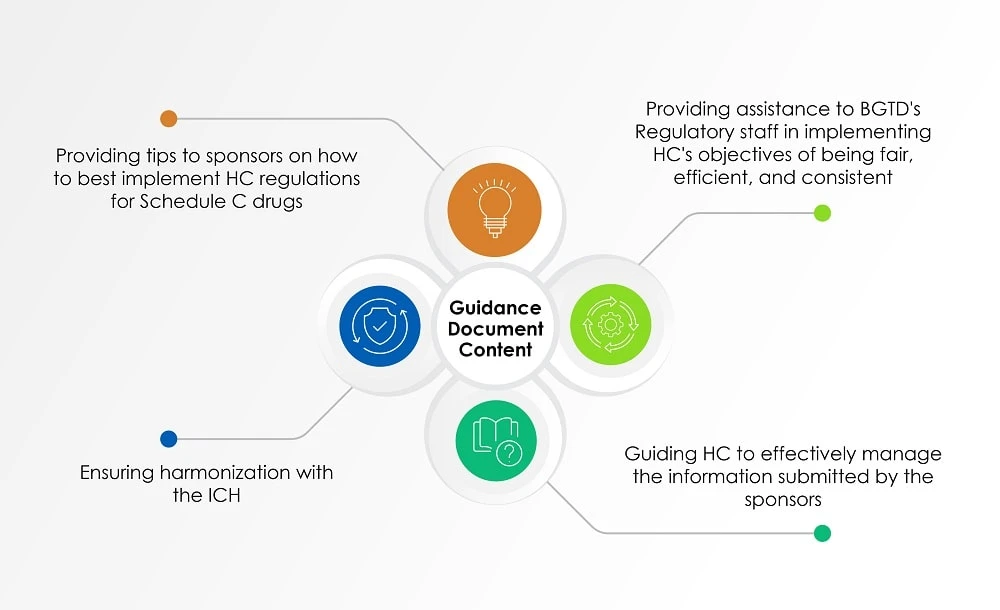
Abbildung 1: Inhalt eines Leitfadens
Die regulatorischen Anforderungen für Arzneimittel der Liste C sind die gleichen wie für andere Arzneimittel. Zu den Anforderungen gehören die Einreichung von Anträgen und die Einhaltung des Verfahrens zur Erlangung der Marktzulassung. Die Anforderungen an die einzureichenden Daten unterscheiden sich jedoch aufgrund ihrer besonderen Eigenschaften von denen anderer Arzneimittel.
NDS
Der Arzneimittelhersteller/Sponsor muss eine New Drug Submission (NDS) bei der BGTD einreichen, die folgende Daten enthalten sollte:
- Informationen über die Sicherheit, Qualität und Wirksamkeit des Arzneimittels.
- Berichte/Ergebnisse von vorklinischen und klinischen Versuchen.
- Informationen über die Herstellung des Arzneimittels.
- Angaben zur Etikettierung und Verpackung.
- Therapeutische Ansprüche und mögliche Nebenwirkungen des Arzneimittels.
Der Sponsor kann vor der Einreichung der NDS eine Präsentation vor dem BGTD halten. Ein solches Treffen vor der Einreichung ist von Vorteil, da der Sponsor auf etwaige Lücken/Fragen des BGTD eingehen und sicherstellen kann, dass die Einreichung alle erforderlichen Informationen enthält. Das Treffen sollte idealerweise drei (03) Monate vor dem Fälligkeitstermin für die Einreichung stattfinden.
Sponsoren können auch alternative Überprüfungswege in Betracht ziehen, z. B. eine vorrangige Überprüfung oder eine Mitteilung über die Erfüllung von Bedingungen (NOC/c). Im Folgenden finden Sie eine Zusammenfassung der beiden Verfahren:
- Vorrangige Prüfung: Dieser Weg gilt für einen NDS- oder Ergänzungsantrag für ein neues Arzneimittel (SNDS) für eine lebensbedrohende oder schwerwiegende Krankheit/einen schwerwiegenden Zustand, für die/den es genügend Beweise für die Wirksamkeit des Arzneimittels in Bezug auf die Diagnose, Behandlung oder Vorbeugung der genannten Krankheit gibt. Sie ist auch anwendbar, wenn es eine wesentliche Steigerung der Wirksamkeit und/oder eine erhebliche Verringerung des Risikos für eine Krankheit gibt, für die es auf dem kanadischen Markt kein wirksames Arzneimittel gibt.
- NOC/c: Dieser Pfad berücksichtigt die Nutzen-Risiko-Bewertung eines Arzneimittels. Der NOC/c ist für ein Medikament, das ein akzeptables Sicherheitsprofil für eine lebensbedrohliche oder schwer beeinträchtigende Krankheit/Zustand aufweist. Die Zulassung wird bei positiver Evidenz für das radiopharmazeutische Arzneimittel erteilt. Dieser Weg gilt für NDS, SNDS und Abbreviated New Drug Submission (ANDS).
Das NDS-Format
HC hat das eCTD-Format (Electronic Common Technical Document) für die Einreichung von radiopharmazeutischen Arzneimitteln übernommen. Für die Einreichung von radiopharmazeutischen Arzneimitteln wurden separate Vorlagen für die Zusammenfassung der Qualitätsinformationen wie QIS-R und QIS-PER erstellt.
Schlussfolgerung
Während HC die Marktzulassung von Radiopharmaka auf der Grundlage einer zufriedenstellenden Bewertung der Sicherheit, Wirksamkeit und Qualität der eingereichten Unterlagen regelt, regelt die Canadian Nuclear Safety Commission (CNSC) die Strahlensicherheit von Radiopharmaka. Die CNSC kontrolliert Aspekte wie die Handhabung, Verpackung, Kennzeichnung, Lagerung, Entsorgung usw. von radioaktivem Material. Außerdem legt sie Vorschriften für die zur Herstellung von radiopharmazeutischen Arzneimitteln verwendeten Geräte fest.
Die Einhaltung der aktuellen Vorschriften der HC und CNSC ist für die zufriedenstellende Bewertung von Anträgen für radiopharmazeutische Arzneimittel unerlässlich. Arbeiten Sie mit einem bewährten Regulierungsexperten wie Freyr zusammen, Freyr fehlerfreie und reibungslose Veröffentlichungs- und Einreichungsprozesse in Kanada Freyr . Bleiben Sie auf dem Laufenden! Bleiben Sie konform!









