
Das Informationssystem für klinische Prüfungen (CTIS) ist eine zentralisierte Datenbank, die die Durchführung klinischer Prüfungen in der Europäischen Union (EU) unterstützt. Es wurde im Januar 2022 eingeführt und ist ein wichtiger Bestandteil der Verordnung über klinische Prüfungen (CTR), die darauf abzielt, die Effizienz und Transparenz klinischer Prüfungen in der EU zu verbessern. Das CTIS eine Reihe von Funktionen, die es zu einem wertvollen Instrument für Sponsoren klinischer Prüfungen, Forscher und Aufsichtsbehörden machen.
Diese Funktionen umfassen:
- Eine zentrale Anlaufstelle für die Einreichung und Verwaltung klinischer Studien in mehreren Ländern.
- Ein sicheres und effizientes Verfahren für den Informationsaustausch zwischen Sponsoren, Forschern und Aufsichtsbehörden.
- Eine öffentlich zugängliche, durchsuchbare Datenbank mit klinischen Studien.
- Instrumente zur Unterstützung der Überwachung und Aufsicht über klinische Prüfungen.
- CTIS bereits positive Auswirkungen auf die Landschaft der klinischen Studien in der EU. Es erleichtert und beschleunigt die Durchführung klinischer Studien und sorgt dafür, dass die Daten aus klinischen Studien transparenter und leichter zugänglich sind.
Entdecken Sie CTIS für Ihre klinischen Studien
Optimieren Sie jetzt Ihre klinischen Studien
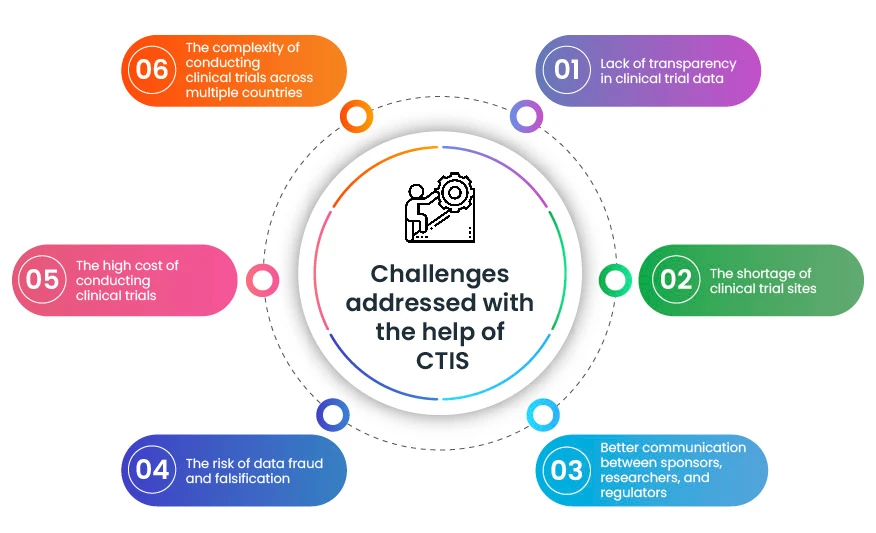
Wie CTIS die Landschaft klinischer Studien CTIS :
- CTIS die Durchführung klinischer Studien in mehreren Ländern:
Bisher mussten Sponsoren für jedes Land, in dem sie eine klinische Studie durchführen wollten, einen separaten Antrag stellen. Dies war ein zeitaufwändiger und kostspieliger Prozess. CTIS Sponsoren einen einzigen Antrag stellen, der in allen Member States gültig ist. Dadurch wurde es für Sponsoren wesentlich einfacher und schneller, klinische Studien in mehreren Ländern durchzuführen.
- CTIS die Effizienz des Überprüfungsprozesses für klinische Studien:
Die Regulierungsbehörden verschiedener Länder können nun über CTIS einfacher zusammenarbeiten. Das bedeutet, dass Anträge nun schneller und effizienter geprüft werden können.
- CTIS für mehr Transparenz bei Daten aus klinischen Studien:
Die öffentliche Website von CTIS Zugang zu Informationen über alle klinischen Studien, die im System registriert sind. Diese Informationen umfassen das Studienprotokoll, die Ergebnisse der Studie und etwaige Sicherheitsbedenken. Diese erhöhte Transparenz trägt dazu bei, das Vertrauen der Öffentlichkeit in klinische Studien zu stärken.
CTIS ein wertvolles Instrument, das bei der Bewältigung einiger zentraler Herausforderungen im Rahmen klinischer Studien hilft. Durch die Vereinfachung, Beschleunigung und Transparenzsteigerung bei der Durchführung klinischer Studien CTIS eine schnelle Bereitstellung neuer Therapien für Patienten.
CTIS noch ein relativ neues System, hat jedoch das Potenzial, die Durchführung klinischer Studien in der EU zu revolutionieren. In einer Welt, in der wissenschaftliche Fortschritte wichtiger denn je sind, kann CTIS in Synergie mit einem globalen Regulierungspartner wie Freyr, den Schlüssel zur Erschließung neuer Grenzen im Gesundheitswesen. Indem wir diese transformativen Technologien nutzen, ebnen wir den Weg für schnellere, sicherere und wirkungsvollere Entdeckungen, die das Potenzial haben, die Zukunft der Medizin für kommende Generationen zu prägen.









