
Die Werbung für Arzneimittel, einschließlich der Direktwerbung für Verbraucher, wird von der Abteilung für die Werbung für verschreibungspflichtige Arzneimittel (Office of Prescription Drug Promotion, OPDP)US (Food and DrugFDAUS FDA), der Abteilung für Werbung und Werbekennzeichnung (Advertising and Promotional Labeling Branch,APLB) des Zentrums für Arzneimittelbewertung und -forschung (Center for Drug Evaluation and Research, CDER) und dem Zentrum für die Bewertung und Forschung biologischer Produkte (Center for Biologics Evaluation and Research, CBER) geregelt. Die dem OPDP und dem APLB vorgelegten Informationen APLB korrekt, ethisch einwandfrei und nicht irreführend sein. Zusätzliche Informationen über die Vorteile und Risiken des Produkts müssen in der Einreichung enthalten sein. Die Ämter prüfen auch die der Behörde vorgelegten Werbematerialien.
Im April 2022FDA die US FDA Leitlinien für die Einreichung von Werbematerialien und Werbebeschriftungen. Die Leitlinien helfen beim Verständnis der elektronischen Einreichung in Modul 1 des eCTD unter Verwendung der Version 3.3 oder höher der US. In dem Dokument werden die Arten von Werbematerialien aufgeführt, die nicht der obligatorischen elektronischen Einreichung gemäß Abschnitt 745A unterliegen. Papierkopien aller Arten von Werbematerialien werden bis vierundzwanzig (24) Monate nach publication der Leitlinien akzeptiert.
Ausnahme
Das Dokument besagt, dass die Einreichungen gemäß Abschnitt 505(b), (i) oder (j) des Federal Food, Drug, and Cosmetic Act (FD&C Act) und Einreichungen gemäß Abschnitt 47 351(a) oder (k) des Public Health Service (PHS) Act in einem von der FDA festgelegten elektronischen Format eingereicht werden müssen. Dieses Dokument unterliegt nicht den üblichen Beschränkungen der FDAgute Leitlinienpraxis, da es keine rechtlich durchsetzbaren Verpflichtungen festlegt. Daher ist der Teil dieser Leitlinie, der die Anforderung für elektronische Einreichungen gemäß Abschnitt 745A(a) des FD&C Act festlegt, verbindlich, wie durch die Verwendung der Wörter „muss“, „soll“ oder „erforderlich“ angezeigt wird.
Die FDA das entworfene Werbematerial innerhalb von fünfundvierzig (45) Tagen nach der freiwilligen Einreichung durch die Sponsoren. Bei Fragen zum Produkt, die von Angehörigen der Gesundheitsberufe, Verbrauchern, Arzneimittelsponsoren oder Anwaltskanzleien gestellt werden, räumt die OPDP den Sponsoren eine Frist von dreißig (30) Kalendertagen ein, um diese zu beantworten.
Definition von Werbematerial
Der Begriff „Werbematerial“ bezieht sich auf Werbekennzeichnungen und Werbematerialien, unabhängig vom Format, der Art oder dem Medium, über das sie kommuniziert werden. Die FDA überwacht FDA zwei (02) Arten der Kennzeichnung von Arzneimitteln:
- FDA Kennzeichnung
- Werbebeschriftung
Gemäß Abschnitt 201(m) FDAwird die Kennzeichnung definiert als „alle Etiketten, die auf einem Behälter, einer Verpackung oder einem Artikel oder einem Begleitartikel schriftlich, gedruckt oder grafisch geprägt sind“. Die Formulierung „Begleitartikel“ wird vom US Gerichtshof US als Interpretation oder Erläuterung des Werbematerials angesehen.
Kriterien für die Einreichung von Werbematerial zur Überprüfung
- Aufnahme geeigneter NDA, ANDA oder BLA
- In Fällen, in denen die Antragsteller eine sofortige Überprüfung benötigen, richten Sie die Eingaben an den OPDP-Projektmanager
- Weisen Sie anhand des Formulars FDA die spezifischste Materialart zu, um das Werbematerial darzustellen.
- Die verschiedenen Arten von Materialien sind getrennt einzureichen
- Vermischen Sie keine anderen Einsendungen mit Werbematerial
- Werbematerial, das sich an Angehörige der Gesundheitsberufe richtet, muss getrennt von demjenigen eingereicht werden, das sich an Verbraucher richtet
Die nachstehenden Zahlen verdeutlichen die Anzahl der eingereichten Formulare 2253 und die darin enthaltenen Materialien.
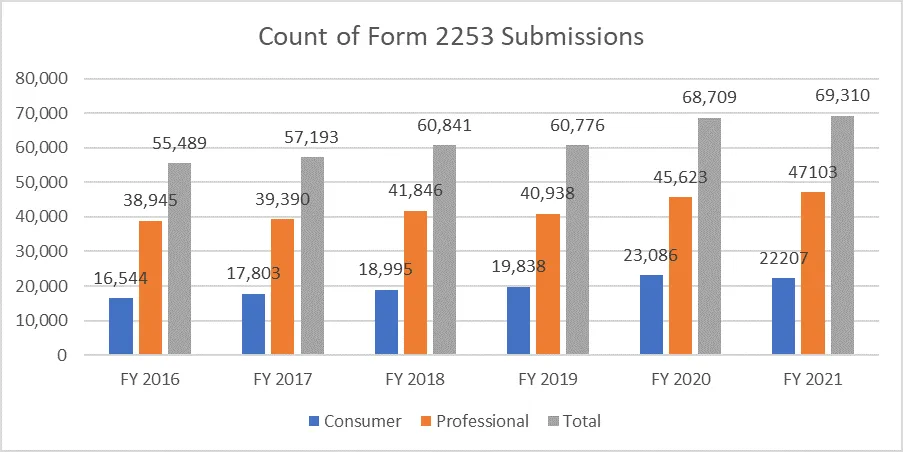
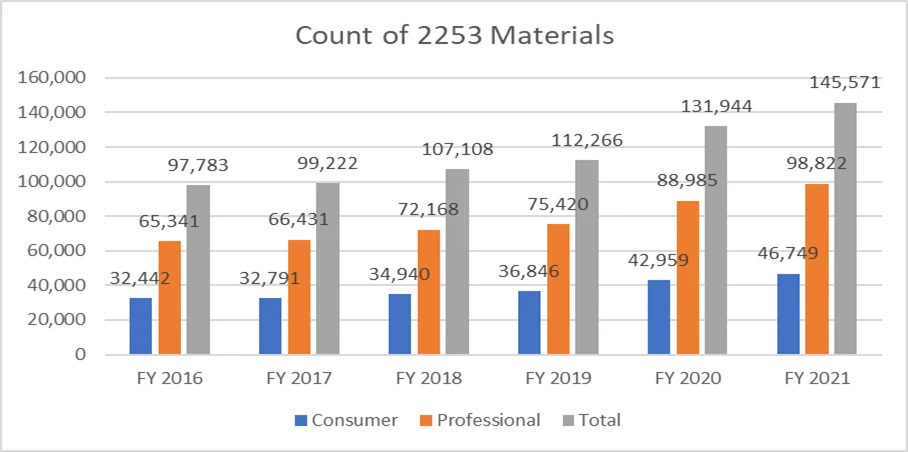
Angesichts der mit diesem Prozess verbundenen Kosten ist es von größter Bedeutung, dass die Sponsoren ihre Werbematerialien gemäß den Vorgaben der FDA erstellen, FDA mehrere Überprüfungszyklen FDA vermeiden. Mit Ressourcen, die den Prozess der Einreichung von Werbematerialien reibungslos unterstützen, können Sponsoren ihre Geschäftsziele erreichen und die regulatorischen Anforderungen erfüllen. Ein bewährter Partner im Bereich Regulatory Affairs wie Freyr eine vollständige Überprüfung von Werbematerialien und nicht werblichen Materialien vor der Einreichung sicherstellen, unabhängig davon, ob diese in elektronischer oder nicht elektronischer Form vorliegen. Wenden Sie sich noch heute an Freyr, um klares, prägnantes und konformes Werbematerial auf Anhieb richtig zu erstellen.









