
Die meisten Life-Science-Unternehmen haben Schwierigkeiten, ihren Prozess für die Einreichung von Zulassungsanträgen zu optimieren, da sich die Richtlinien für die Einreichung häufig ändern. Laut einer aktuellen Analyse der US-amerikanischen Food and Drug Administration (USFDA) wiesen 32 % der eingereichten Anträge mit Studiendaten kritische Probleme hinsichtlich der Datenkonformität auf. Der Prozess erfordert ein umfassendes Verständnis der Zusammenarbeit zwischen internen und externen Stakeholdern. Innerhalb des Unternehmens müssen die Abteilungen Fertigung, Forschung und Entwicklung, klinische/nichtklinische Forschung, QA, Marketing und Vertrieb harmonisch zusammenarbeiten, um den Zulassungsprozess von der ersten Entwicklung bis zur Markteinführung des Arzneimittels zu beschleunigen. Die Abteilung für Regulatory Affairs und die Gesundheitsbehörden (HAs) stehen in ständigem Kontakt, um die Sicherheit und Wirksamkeit von Arzneimitteln für den menschlichen Gebrauch zu gewährleisten und zu bewerten. us , welche vorbereitenden Maßnahmen Pharmaunternehmen ergreifen müssen, um eine hervorragende Qualität ihrer Zulassungsanträge zu erreichen:
Zuteilung und Einsatz von Ressourcen zur Rationalisierung, Standardisierung und Beschleunigung der unorganisierten Einreichungsarbeit
Ein Einreichungsspezialist nimmt auf vertraglicher Basis teil und kann mehr als eine (01) Art von Einreichung verstehen, während er im Laufe der Jahre mit Entwicklungsprogrammen in Verbindung gebracht wird und dabei hilft, überzeugende Erzählungen für das Dossier zu verfassen. Auf diese Weise wird es für Organisationen einfacher:
- Beseitigung von Fehlern durch ausgewogene Zusammenarbeit zwischen internen und externen Beteiligten
- Verkürzung des HA-Überprüfungszyklus für die Erstellung und Genehmigung von Dokumenten
- Erstellung vollständiger und vorschriftsmäßiger Einreichungen, um mit den sich ändernden rechtlichen Anforderungen für verschiedene Märkte Schritt zu halten
- Bestätigen Sie die von einer Regulierungsbehörde betroffenen Eingaben
- den Status der Erstellung, Überprüfung und Genehmigung von Anträgen zu kennen
- Verbesserung des aktuellen Einreichungsprotokolls
Vereinfachung der Methodik für die Einreichung von Dossiers
Das Verfassen eines Dossiers ist bei der Vorbereitung von Anträgen von größter Bedeutung. Es ist zu beobachten, dass die Anträge auf biologische Lizenzen (BLAs) und die Anträge auf neue Arzneimittel (NDAs) tonnenweise Seiten umfassen, was es für die Behörden schwierig macht, den Inhalt des Dossiers zu verstehen. Eine strukturierte Darstellung einer allgemeinen Idee kann die Fähigkeit des Teams zur Vorbereitung von Anträgen und die der Behörden, die sie prüfen, verbessern.
Die Verwendung von Modulen zur Straffung der Einreichungen ermöglicht es den Experten zu analysieren, was in jedem Abschnitt oder Modul des Dossiers enthalten sein muss. Eine solche Vorgehensweise erleichtert:
- Frühzeitiger Beginn der Erstellung von Dokumenten durch Beschleunigung der Vorbereitung der Einreichung durch die Organisation
- Verwendung relevanter Daten, die für die Erstellung der Stellungnahmen erforderlich sind
- Nutzung geeigneter Ressourcen, ohne dass für jede Vorlage umfangreiche Dokumente von Grund auf neu geschrieben werden müssen
Zusammenarbeit mit den Aufsichtsbehörden
Jede Organisation muss in der Frühphase der Produktentwicklung regelmäßige Treffen mit den zuständigen Behörden abhalten. Dies gewährleistet eine rechtzeitige Überprüfung und Rückmeldung, was zu einer schnelleren Lösung der Kommentare durch die Zulassungsbehörde und folglich zu einem schnelleren Genehmigungsverfahren führt. Dadurch wird nicht nur ein gutes Verhältnis zwischen den Organisationen und den Zulassungsbehörden aufgebaut, sondern auch Klarheit in einem frühen Stadium der Einreichungsplanung geschaffen.
Rationalisierung von Inhalten und Daten im Dokumentenmanagementsystem (DMS)
Ein robustes Content-Repository muss alle Daten aus verschiedenen Funktionsbereichen verarbeiten können, einschließlich zuvor erstellter Dokumentationen und Informationen. Strukturierte Inhalte und Datenrepositorien ermöglichen einen nahtlosen Zugriff auf Dokumente aus verschiedenen Funktionsbereichen, ohne dass zusätzlicher Aufwand entsteht oder Duplikate erstellt werden müssen. Die im DMS gespeicherten Dokumente werden zur einzigen Kontaktquelle für alle internen Stakeholder (klinische Wissenschaft, CMC, nichtklinische Bereiche, Pharmakokinetik, Pharmakodynamik, medizinisches Schreiben und klinische Operationen). Diese Inhalte und Daten können zur Erstellung lokaler Inhalte auf der Grundlage regionaler Anforderungen genutzt werden. Optimierung von Zulassungsanträgen durch strukturiertes Content- und Datenmanagement
Einsatz von Technologie und Automatisierung zur Reduzierung von sich wiederholenden Arbeiten und Fehlern
Unternehmen können sich die Technologie zunutze machen, indem sie die automatische Aktualisierung und Qualitätskontrolle der Tabellen, Auflistungen und Abbildungen im Text (TLF) mit den Quelldaten nutzen, um den Dokumentationsprozess zu beschleunigen. Auf diese Weise wird bei jeder Änderung an den vorhandenen Quellentabellen das TLF im Text entsprechend aktualisiert. Dies trägt dazu bei, die Gesamtarbeitszeit zu verringern, Zeit auf dem kritischen Pfad zu sparen und die Datengenauigkeit zu verbessern.
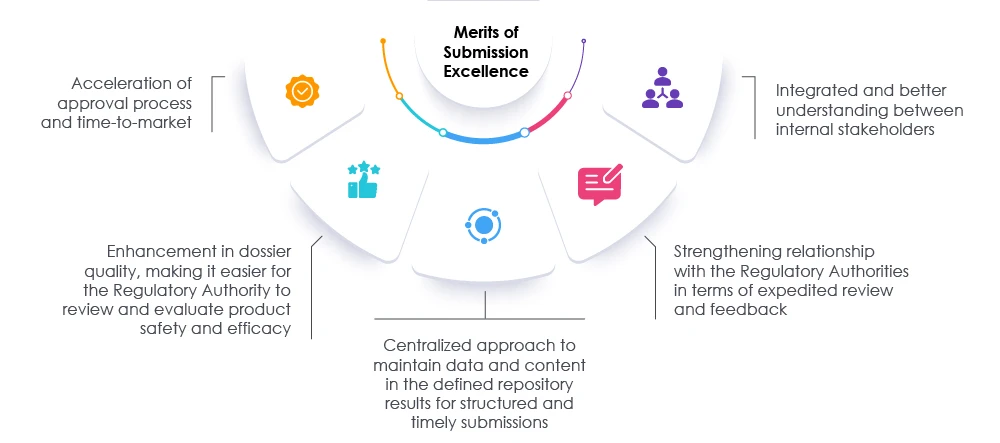
Durch geeignete Maßnahmen und die zeitnahe Überprüfung der Dossiers und Daten können sowohl Aufsichtsbehörden als auch Unternehmen den Einreichungsprozess beschleunigen. Dieser Ansatz verkürzt die Markteinführungszeit und trägt so den Bedürfnissen der Patienten und der Branche gerecht. Ein bewährter Partner im Bereich Regulatory Affairs kann Unternehmen dabei unterstützen, ihre derzeitigen Ansätze zur Vorbereitung von Einreichungen zu überdenken, neu zu bewerten und anzupassen. Unsere Experten bei Freyr den Weg zu exzellenten Zulassungsanträgen ebnen, indem sie die Transparenz im gesamten Unternehmen erhöhen und die allgemeine Compliance fördern, sodass das Unternehmen auf dem heutigen Markt für Biowissenschaften erfolgreich sein kann. Wenden Sie sich an Freyr.









