
Das Änderungsmanagement nach der Zulassung ist ein wesentlicher, aber oft übersehener Aspekt des pharmazeutischen Produktlebenszyklusmanagements. Nach der Zulassung eines Arzneimittels muss es weiterhin die behördlichen Standards erfüllen, um seine Sicherheit, Wirksamkeit und Qualität zu gewährleisten. Dies beinhaltet notwendige Änderungen am Produkt, am Herstellungsprozess oder an der Verpackung.
Diese Änderungen reichen oft von der Verbesserung der Produktionseffizienz über die Behebung von Sicherheitsproblemen bis hin zur Einhaltung der neuesten und/oder neuen gesetzlichen Vorschriften. Die Verwaltung dieser Änderungen birgt jedoch einige versteckte Herausforderungen, die sich auf den Lebenszyklus und die Marktpräsenz des Produkts auswirken können. Bei einem solchen Unterfangen ist ein Partner aus dem Bereich Regulierung erforderlich, der sich um das Management solcher Änderungsprozesse kümmert und die regulatorischen Abläufe reibungslos steuert.
Hürden für ein Pharmaunternehmen
Der Umgang mit Änderungen nach der Zulassung ist komplex und regional sehr unterschiedlich, was zu Hürden bei der Einhaltung von Vorschriften führt. Hinzu kommt, die Sicherstellung der Datenintegrität, die Koordinierung mehrerer Beteiligterund Verwaltung der umfangreichen Dokumentation kann entmutigend sein. Wenn diese Aspekte nicht effektiv gehandhabt werden, kann dies zur Nichteinhaltung gesetzlicher Vorschriften, zu Produktrückrufen und zu schwerwiegenden Schäden für den Ruf und den Betrieb führen.
Wenige Herausforderungen bei der Umsetzung des Änderungsmanagements nach der Zulassung
- Komplexität der Rechtsvorschriften
- Die verschiedenen Gesundheitsbehörden auf der ganzen Welt haben einzigartige Anforderungen für Änderungen nach der Zulassung, die ein tiefes Verständnis der spezifischen Richtlinien und Fristen jeder Region erfordern. Das Verständnis dieser Unterschiede ist entscheidend für eine rechtzeitige und erfolgreiche Einreichung.
- Verzögerungen beim Verständnis dieser Vorschriften können zu erheblichen Rückschlägen im Lebenszyklus des Produkts führen.
- Integrität der Daten
- Die Sicherstellung der Genauigkeit und Integrität der für Änderungen nach der Zulassung eingereichten Daten ist von größter Bedeutung. Ungenaue oder unvollständige Daten können zu behördlichen Ablehnungen und erheblichen Verzögerungen führen.
- Die Aufrechterhaltung hoher Datenqualitätsstandards erfordert strenge Validierungsprozesse und häufige Audits, um Unstimmigkeiten zu vermeiden.
- Koordinierung der Interessengruppen
- Ein effektives Änderungsmanagement nach der Zulassung erfordert die Koordination zwischen internen Teams (z. B. F&E, Fertigung und Qualitätssicherung) und externen Partnern (z. B. Auftragsfertigungsunternehmen).
- Der Einsatz von Projektmanagement-Tools und regelmäßige funktionsübergreifende Besprechungen können die Zusammenarbeit verbessern und sicherstellen, dass alle Beteiligten aufeinander abgestimmt sind.
- Dokumentation
- Eine detaillierte und präzise Dokumentation ist entscheidend für den Nachweis der Konformität und die Erleichterung reibungsloser Überprüfungsverfahren.
- Im Gegenteil, eine schlechte Dokumentationspraxis kann zu Rückfragen der Behörden, zusätzlichen Datenanforderungen und Verzögerungen bei der Einreichung führen.
- Risikomanagement
- Ein proaktives Risikomanagement hilft dabei, Herausforderungen zu antizipieren und Lösungen zu implementieren, um den Einreichungsprozess auf Kurs zu halten.
- Ein wirksamer Risikomanagementplan minimiert die Wahrscheinlichkeit von Rückschlägen bei der Regulierung und gewährleistet die kontinuierliche Einhaltung der Vorschriften.
Die Rolle des Regulierungsexperten
Regulierungsexperten spielen eine wichtige Rolle bei der Bewältigung dieser Herausforderungen, indem sie Fachwissen und Unterstützung bereitstellen:
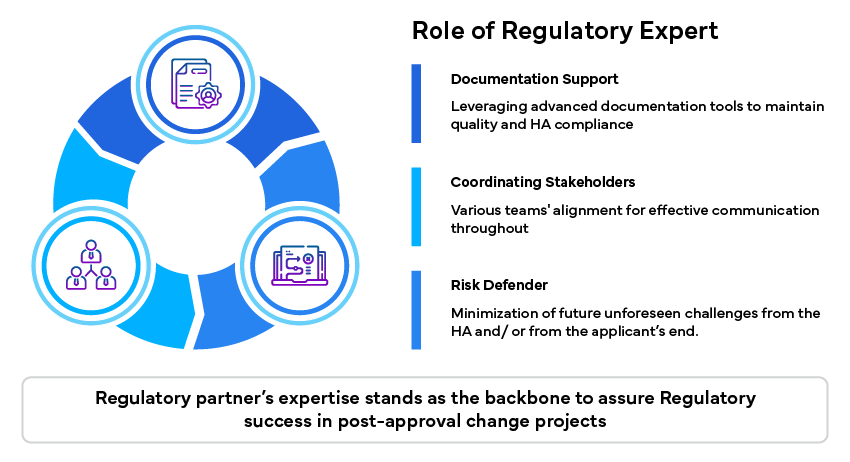
Zusammenfassung
Ein effektives Änderungsmanagement nach der Zulassung ist für die Aufrechterhaltung der Qualität, Sicherheit und Wirksamkeit von pharmazeutischen Arzneimitteln unerlässlich. Um die Genehmigungen der Zulassungsbehörde für das Änderungsmanagement zu erhalten, ist es notwendig, die Komplexität der Vorschriften zu beherrschen. Zulassungsexperten bieten unschätzbare Unterstützung bei der Bewältigung dieser Herausforderungen, indem sie ihr Fachwissen zur Verfügung stellen, die Koordination erleichtern und Risiken mindern. Durch die Nutzung ihrer Fähigkeiten können Antragsteller ein erfolgreiches Änderungsmanagement nach der Zulassung sicherstellen und die Marktpräsenz ihrer Produkte erhalten.









