
Arzneimittel für neuartige Therapien (ATMPs) stellen einen innovativen Ansatz in der Medizin dar, bei dem die Kraft von Zellen, Geweben oder Genen zur Behandlung einer Vielzahl von Erkrankungen genutzt wird. Aufgrund ihrer Komplexität und Neuartigkeit sind die regulatorischen Anforderungen an Arzneimittel für neuartige Therapien (ATMPs) verständlicherweise streng. Dies gilt auch für die in den Zulassungsanträgen artwork , die eine entscheidende Rolle bei der klaren und prägnanten Vermittlung wichtiger Informationen spielen.
Bei der Anpassung von regulatorischen artwork Arzneimittel für neuartige Therapien (ATMPs) sollten folgende Überlegungen berücksichtigt werden:
Wenden Sie sich an unsere Artwork für regulatorische Artwork
Konsultation anfordern
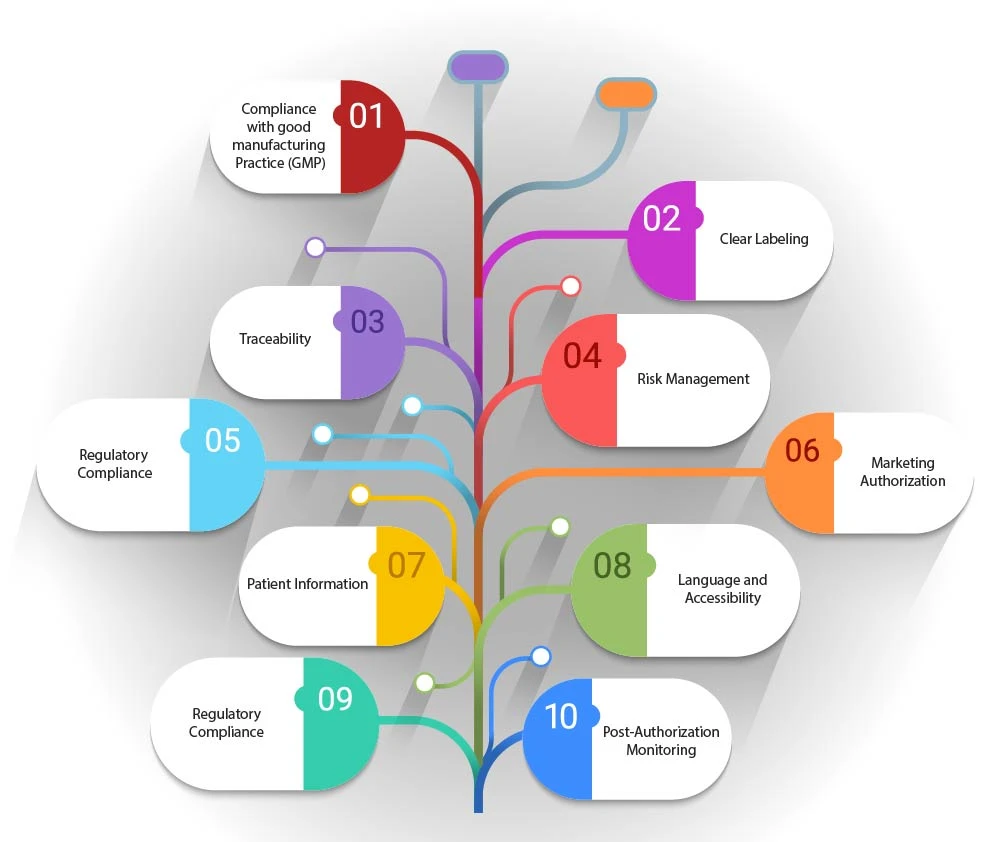
- Einhaltung der Guten Herstellungspraxis (GMP): Das artwork den GMP-Richtlinien für ATMPs entsprechen, die unter anderem Angaben zum Herstellungsprozess, zur Qualitätskontrolle und zur Rückverfolgbarkeit enthalten können.
- Eindeutige Kennzeichnung: Die artwork Aufschluss über die Art des Produkts geben, darunter auch darüber, ob es sich um ein Produkt der Gentherapie, der somatischen Zelltherapie oder der Gewebezüchtung handelt. Außerdem sollten alle besonderen Anforderungen hinsichtlich Lagerung und Handhabung angegeben werden.
- Rückverfolgbarkeit: Angesichts des personalisierten Charakters vieler Arzneimittel für neuartige Therapien (ATMPs) artwork das artwork die Rückverfolgbarkeit erleichtern. Dies kann eindeutige Kennungen oder Barcodes umfassen, die die Rückverfolgung des Produkts von der Herstellung bis zur Verabreichung an den Patienten ermöglichen.
- Risikomanagement: Artwork Informationen zum Risikomanagement enthalten, wie beispielsweise mögliche Nebenwirkungen oder Kontraindikationen, um sicherzustellen, dass Patienten und Gesundheitsdienstleister umfassend informiert sind.
- Einhaltung gesetzlicher Vorschriften: Das artwork den gesetzlichen Rahmenbedingungen entsprechen, die durch Rechtsvorschriften wie die Verordnung (EG) Nr. 1394/2007 festgelegt sind, in der die Anforderungen für die Zulassung, Überwachung und Pharmakovigilanz von ATMPs festgelegt sind.
- Zulassung: Die artwork den Status der Zulassung des Produkts widerspiegeln, unabhängig davon, ob es vollständig zugelassen ist, sich in der klinischen Testphase befindet oder einer Krankenhausausnahme unterliegt.
- Patienteninformation: Artwork Patienteninformationsbroschüren enthalten, die umfassende Informationen über das ATMP, seine Anwendung und alle möglicherweise nach der Verabreichung erforderlichen Überwachungsmaßnahmen enthalten.
- Sprache und Zugänglichkeit: Das artwork so gestaltet sein, dass es zugänglich und verständlich ist, wobei die Sprache und Lesbarkeit der bereitgestellten Informationen zu berücksichtigen sind.
- Informationen zu den Aufsichtsbehörden: Das artwork Informationen zu den zuständigen Aufsichtsbehörden enthalten, beispielsweise zur Europäischen Arzneimittelagentur (EMA) und zum Ausschuss für neuartige Therapien (CAT), die für die Bewertung und Zulassung von Arzneimitteln für neuartige Therapien (ATMPs) zuständig sind.
- Überwachung nach der Zulassung: Gegebenenfalls artwork in der artwork auf eine Überwachung nach der Zulassung oder zusätzliche Studien hingewiesen werden, die zur weiteren Bewertung der langfristigen Sicherheit und Wirksamkeit des ATMP erforderlich sind.
Die Anpassung artwork regulatorischen artwork ATMPs erfordert einen sorgfältigen Ansatz, bei dem wissenschaftliche Genauigkeit, klare Kommunikation und die Einhaltung sich ständig weiterentwickelnder regulatorischer Anforderungen in Einklang gebracht werden müssen. Interne Fachkenntnisse sind zwar wertvoll, doch kann es von großem Vorteil sein, sich in diesem komplexen Umfeld zurechtzufinden.
Hier Freyr Solutions die Zusammenarbeit mit einem Spezialisten wie Freyr Solutions ins Spiel. Freyr verfügt über ein Team von artwork regulatorische artwork mit umfassender Erfahrung im Bereich ATMPs. Sie kennen die besonderen Herausforderungen im Zusammenhang mit artwork verfügen über die technischen Fähigkeiten, um klare, konforme und wirkungsvolle Grafiken zu erstellen.
In der heutigen Wettbewerbslandschaft kann eine überzeugende Zulassungsunterlage über Erfolg oder Misserfolg entscheiden. Durch die Zusammenarbeit mit Freyr Solutionsstellen Sie sicher, dass Ihre artwork das Potenzial Ihrer Therapie artwork präsentieren und ebnen so den Weg für einen reibungsloseren Zulassungsprozess. Mit seinem Fachwissen und seinem kooperativen Ansatz ist Freyr ein unschätzbarer Partner bei der Markteinführung Ihrer bahnbrechenden ATMP. Kontaktieren Sie uns noch heute!









