
In der immer komplexer werdenden Welt der klinischen Forschung greifen Pharma- und Biotech-Unternehmen bei der Durchführung klinischer Studien häufig auf externe Partner zurück. Diese Partnerschaften bieten erhebliche Vorteile, darunter den Zugang zu spezialisiertem Fachwissen, fortschrittlichen Technologien und verbesserter betrieblicher Effizienz. Um diese Vorteile zu maximieren und den Erfolg klinischer Studien zu gewährleisten, ist es jedoch entscheidend, eine solide Aufsicht über die Antragsteller und Sponsoren zu gewährleisten. In diesem Blog wird die Bedeutung der Aufsicht über Antragsteller/Sponsoren bei klinischen Vertragsstudien untersucht und wie sie zu zuverlässigeren und wirkungsvolleren Forschungsergebnissen führen kann.
Die Rolle der Antragsteller/Sponsoren als Aufsichtsbehörde:
Die Beaufsichtigung durch den Antragsteller/Sponsor bezieht sich auf die proaktive Verwaltung und Überwachung der in Auftrag gegebenen klinischen Studien durch das Sponsorunternehmen.
Was beinhaltet die Aufsicht über den Antragsteller/Sponsor?
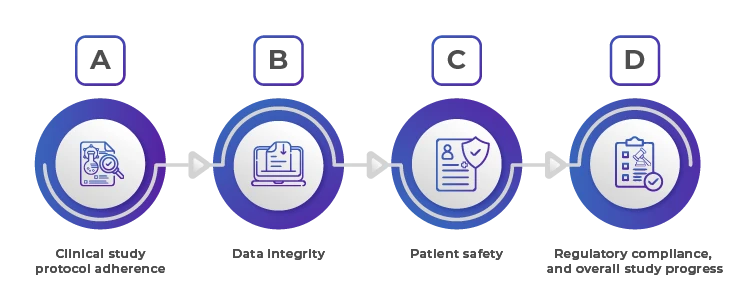
Durch eine wirksame Aufsicht wird sichergestellt, dass die Studie gemäß den vorgegebenen Standards und Vorschriften durchgeführt wird, wodurch die Sicherheit, Integrität und Gültigkeit der Forschungsergebnisse.
Hauptaspekte der Aufsicht über Antragsteller und Sponsoren:
1. Einhaltung des Protokolls der klinischen Studie
Es ist von entscheidender Bedeutung, dass die beauftragte Organisation das Studienprotokoll buchstabengetreu befolgt. Jede Abweichung kann die Gültigkeit der Studienergebnisse beeinträchtigen und zu einer behördlichen Überprüfung führen. Regelmäßige Audits und Kontrollbesuche sind unerlässlich, um die Einhaltung des Protokolls zu überprüfen. Der Sponsor muss klare, detaillierte Richtlinien bereitstellen und regelmäßige Schulungen durchführen, um sicherzustellen, dass alle Beteiligten das Protokoll verstehen und befolgen.
- Detaillierte Protokollschulung: Umfassende Schulungen zum Prüfplan für alle an der klinischen Studie beteiligten Personen stellen sicher, dass jeder die Ziele, Verfahren und erwarteten Ergebnisse der Studie versteht. Dazu gehören die Erstellung detaillierter Schulungshandbücher und die Durchführung regelmäßiger Auffrischungssitzungen.
- Prüfpfade: Die Erstellung von Prüfpfaden hilft, jede Änderung am Prüfplan und an den Daten nachzuvollziehen. Diese Dokumentation ist entscheidend für die Aufrechterhaltung von Transparenz und Verantwortlichkeit und ermöglicht die Identifizierung von Abweichungen vom Protokoll.
2. Datenintegrität
Genaue und zuverlässige Daten sind der Eckpfeiler jeder klinischen Studie. Zu den Überwachungsmechanismen sollten regelmäßige Datenüberprüfungen, Quelldatenüberprüfungen und Audits gehören, um sicherzustellen, dass die Daten korrekt erfasst, aufgezeichnet und gemeldet werden. Dazu gehört auch die Sicherstellung, dass die elektronischen Datenerfassungssysteme validiert und sicher sind. Die Einführung solider Datenverwaltungspraktiken und der Einsatz fortschrittlicher Datenanalyseverfahren können bei der frühzeitigen Erkennung von Diskrepanzen und Anomalien helfen.
- Datenverwaltungssysteme: Der Einsatz hochentwickelter Datenverwaltungssysteme, die die Datenerfassung, -validierung und -analyse in Echtzeit unterstützen, gewährleistet die Integrität und Genauigkeit der klinischen Daten. Diese Systeme sollten mit den regulatorischen Standards wie 21 CFR Part 11 übereinstimmen.
- Prüfungen der Datenqualität: Regelmäßige Qualitätskontrollen und Datenbereinigungsprozesse tragen dazu bei, Unstimmigkeiten oder Fehler in den Daten zu erkennen und zu beheben, um sicherzustellen, dass der endgültige Datensatz zuverlässig und für die Analyse bereit ist.
3. Patientensicherheit
Die Sicherheit der Studienteilnehmer steht an erster Stelle. Die Sponsoren müssen sicherstellen, dass die beauftragte Organisation über robuste Systeme zur Überwachung unerwünschter Ereignisse und zur unverzüglichen Umsetzung von Korrekturmaßnahmen verfügt. Dazu gehören regelmäßige Sicherheitsüberprüfungen und die Gewährleistung der Einhaltung der Richtlinien der Guten Klinischen Praxis (GCP). Regelmäßige Sicherheitsaudits, Mechanismen zur Rückmeldung an die Patienten und Echtzeit-Überwachungsinstrumente sind unerlässlich, um das Wohl der Patienten zu gewährleisten.
- Systeme zur Meldung unerwünschter Ereignisse: Die Einführung effizienter Meldesysteme für unerwünschte Ereignisse gewährleistet, dass potenzielle Sicherheitsprobleme rasch erkannt und angegangen werden. Diese Systeme sollten eine sofortige Meldung und Nachverfolgung von unerwünschten Ereignissen ermöglichen.
- Technologien zur Patientenüberwachung: Moderne Technologien zur Patientenüberwachung, wie z. B. tragbare Geräte, können kontinuierliche Gesundheitsdaten liefern, die ein rechtzeitiges Eingreifen ermöglichen und die Sicherheit der Patienten während der gesamten Studie gewährleisten.
4. Einhaltung von Vorschriften
Klinische Studien müssen den lokalen und internationalen gesetzlichen Bestimmungen entsprechen. Zu einer wirksamen Aufsicht gehört es, sicherzustellen, dass die beauftragte Organisation diese Vorschriften einhält und dass alle erforderlichen Genehmigungen und Unterlagen vorhanden sind. Dazu gehört auch, dass man das regulatorische Umfeld jeder Region, in der die Studie durchgeführt wird, kennt und sicherstellt, dass die gesamte Dokumentation auf dem neuesten Stand ist und für behördliche Überprüfungen zur Verfügung steht.
- Regulatorische Schulung: Durch die laufende Schulung des gesamten Studienpersonals zu den gesetzlichen Bestimmungen wird sichergestellt, dass es alle relevanten Vorschriften und Richtlinien kennt und einhält.
- Verwaltung der behördlichen Dokumentation: Die Implementierung robuster Systeme für die Verwaltung der behördlichen Dokumentation stellt sicher, dass alle erforderlichen Genehmigungen, Berichte und Aufzeichnungen korrekt verwaltet werden und für Audits und Inspektionen leicht zugänglich sind.
Vorteile einer wirksamen Aufsicht über Antragsteller und Sponsoren
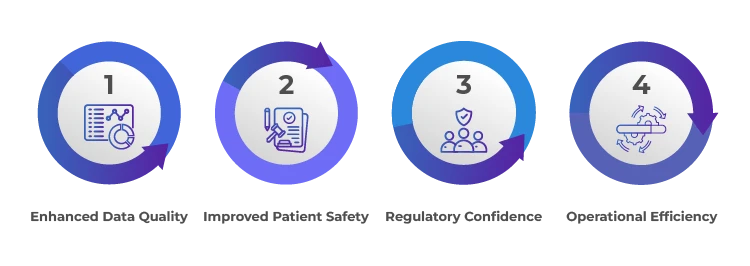
Zusammenfassung
Die Aufsicht über Antragsteller/Sponsoren bei klinischen Auftragsstudien ist nicht nur eine behördliche Anforderung, sondern ein strategisches Gebot. Sie gewährleistet die Integrität, Sicherheit und Verlässlichkeit der klinischen Forschung und führt letztlich zu solideren und glaubwürdigeren Studienergebnissen. Das Fachwissen eines Regulierungspartners in Bezug auf regulatorische Dienstleistungen und umfassende Überwachungskapazitäten kann Ihnen helfen, die Komplexität klinischer Studien zu bewältigen und sicherzustellen, dass Ihre Forschung nach den höchsten Standards durchgeführt wird. Gehen Sie eine Partnerschaft mit Freyr ein, um die Aufsicht über Ihre klinische Forschung zu verbessern und Ihre Studienziele mit Zuversicht zu erreichen.









