
Stellen Sie sich vor, Sie arbeiten an einem neuen Medikament zur Behandlung einer verheerenden Krankheit. Nach Jahren harter Arbeit haben Sie endlich die Daten gesammelt, die Sie für die Einreichung eines Zulassungsantrags bei der FDA benötigen. Doch dann stellen Sie fest, dass Ihre elektronischen Aufzeichnungen und elektronischen Signaturen nicht mit 21 CFR Part 11 konform sind. Das ist ein Szenario, in das niemand geraten möchte. Die Welt der regulatorischen Compliance ist komplex und unterliegt einem ständigen Wandel. Da ständig neue Vorschriften eingeführt werden, kann es für Unternehmen schwierig sein, den Überblick zu behalten. Eine Vorschrift ist jedoch für jedes Unternehmen, das in einer regulierten Branche tätig ist, von entscheidender Bedeutung: 21 CFR Part 11.
21 CFR Part 11 eine Vorschrift, die die Kriterien für elektronische Aufzeichnungen und elektronische Signaturen in FDA Branchen festlegt. Sie soll sicherstellen, dass elektronische Aufzeichnungen vertrauenswürdig und zuverlässig sind und den Aufzeichnungen in Papierform und handschriftlichen Unterschriften gleichwertig sind. 21 CFR Part 11 für Zulassungsanträge relevant, da sie Leitlinien zur Sicherstellung der Konformität elektronischer Aufzeichnungen und elektronischer Signaturen mit FDA enthält. Dies ist wichtig, da Zulassungsanträge oft eine erhebliche Menge an elektronischen Daten enthalten, wie z. B. Daten aus klinischen Studien, Herstellungsunterlagen und Daten zur Qualitätskontrolle.
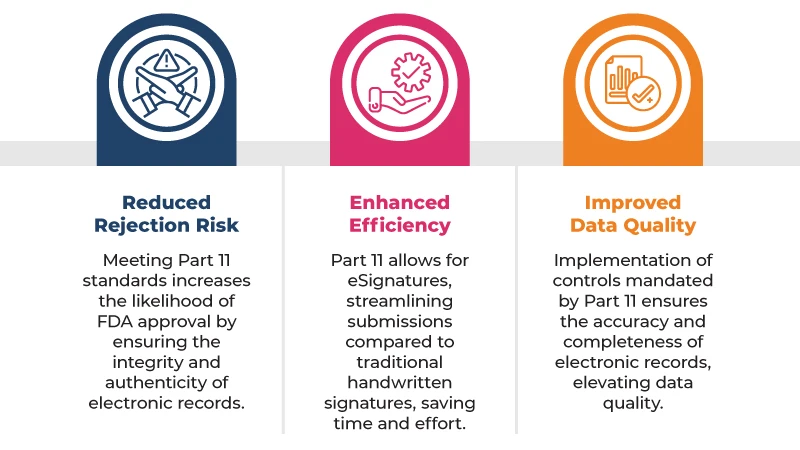
Hier sind einige der wichtigsten Vorteile der Einhaltung von 21 CFR Part 11 behördliche Einreichungen:
Um die Anforderungen von 21 CFR Part 11 zu erfüllen, müssen Unternehmen eine Reihe von Kontrollen implementieren, darunter:
- Systeme validieren: Stellen Sie sicher, dass elektronische Systeme die Anforderungen von Part 11 erfüllen, einschließlich robuster Sicherheit, Prüfpfade und Datenintegritätstests.
- Kontrolle des Benutzerzugangs: Beschränken Sie den Zugriff auf autorisiertes Personal durch Passwortschutz, elektronische Signaturen und andere Authentifizierungsmethoden.
- Pflege von Prüfpfaden: Implementieren Sie Prüfpfade, um alle Datensatzänderungen nachzuverfolgen und so die Aufdeckung und Untersuchung unbefugter Änderungen zu ermöglichen.
- Gewährleistung der Datensicherheit: Setzen Sie Datensicherheitsmaßnahmen ein, um elektronische Aufzeichnungen vor unbefugtem Zugriff, Verwendung, Offenlegung, Störung, Änderung oder Zerstörung zu schützen.
Durch die Einhaltung von 21 CFR Part 11 können Unternehmen dazu beitragen, dass ihre elektronischen Daten aus klinischen Studien zuverlässig und vertrauenswürdig sind. Dies ist wichtig, da FDA eher Zulassungsanträge genehmigen, die hochwertige elektronische Daten aus klinischen Studien enthalten.
21 CFR Part 11 ist für eine erfolgreiche Einreichung bei der FDA unerlässlich. Mit einer Einreichungssoftware wie Freyr PRO, die die Verwaltung zentralisiert, die Zusammenarbeit verbessert, eine schnelle eCTD-Einreichung gewährleistet und 21 CFR Part 11 , können Sie dies erreichen. Um mehr zu erfahren, fordern Sie jetzt eine Demo an!









