
Zusätzlich zur Einreichung der erforderlichen xEVMPD müssen Life-Science-Unternehmen nun ein webbasiertes Antragsformular namens Digital Application Dataset Integration (DADI) verwenden. Die Europäische Arzneimittelagentur (EMA) hat DADI als langfristigen Ersatz für das PDF-basierte elektronische Antragsformular (eAF) entwickelt, das zur Unterstützung von eCTD-Einreichungen eingeführt wurde.
Die Zeitpläne für diesen Übergang wurden kürzlich von der EMA veröffentlicht. DADI wird im Jahr 2022 das Formular für Änderungen an Arzneimitteln ersetzen. Weitere Einreichungsformulare für zentral zugelassene Produkte (CAP) und national zugelassene Produkte (NAP) werden bald darauf im Jahr 2023 folgen. Das Projekt wird auch die Formulare ersetzen, die für die wichtigsten EU-Verfahren verwendet werden, darunter das zentralisierte Verfahren (CP), das Verfahren der gegenseitigen Anerkennung (MRP), das dezentralisierte Verfahren (DCP) und das nationale Verfahren (NP).
Die Webformulare (einschließlich des Human Variations Form (HVF) für Humanarzneimittel) sorgen für einheitliche Eingaben in eAFs, um standardisierte Produktstammdaten für Arzneimittel bereitzustellen. Sie ermöglichen sowohl die bestehende menschenlesbare als auch die neue maschinenlesbare Ausgabe für die digitale Verarbeitung auf der Grundlage des Datenaustauschstandards Fast Healthcare Interoperability Resources (FHIR) für Arzneimittel. Außerdem werden sie vorhandene Produktstammdaten aus den Product Management Services (PMS) verwenden, um die Formularfelder, soweit möglich, vorab auszufüllen.
Die webbasierten Formulare des DADI sollen eine methodischere Bearbeitung von Anträgen ermöglichen und damit die Arbeitsbelastung der Organisation verringern. So werden beispielsweise Fehler und Unstimmigkeiten reduziert, da die Formulare die Prüfung der eingereichten Anträge durch die Gesundheitsbehörden unterstützen. Die Formulare machen auch den Weg frei für die Einspeisung von "first-time-right"-Daten in Datenbanken, was die Integration von Systemen und den Datenaustausch zwischen Gesundheitsbehörden mühelos macht. Darüber hinaus werden die neuen Formulare die archaische Technologie ersetzen.
Vorteile von DADI
Das Ziel von DADI und dieser datengesteuerten Umgestaltung von Regulierungsprozessen lässt sich wie folgt zusammenfassen:
- Steigerung der Effizienz in den Bereichen Regulierung, F&E und Produktion
- Schnellere Kommunikation mit den Gesundheitsbehörden
- Ermöglichung einer datengestützten Entscheidungsfindung sowohl für Unternehmen als auch für Behörden
- Bessere Einblicke und Vorausschau auf die Geschäftsergebnisse und die Gesamtleistung
Dies soll sowohl für die Patienten als auch für die Regulierungsbehörden und die Industrie von Vorteil sein.
Neueste Änderungen der Zeitachse durch die EMA
- Der Termin für die Einführung der LSVA wurde von April 2022 auf Oktober 2022 verschoben.
- Zurzeit wird die LSVA von einer Gruppe von Fachexperten der DADI einem geschlossenen User Acceptance Testing (UAT) unterzogen.
- Anschließend wird im zweiten Quartal 2022 ein integrierter UAT mit einer größeren Gruppe verschiedener Interessengruppen stattfinden.
- Nach der Inbetriebnahme wird es eine sechsmonatige Übergangsphase geben, in der sowohl die eAFs (alte PDF-Version) als auch die webbasierten Formulare parallel angenommen werden. Danach wird nur noch die LSVA akzeptiert.
Bitte beachten Sie die folgenden Zeitpläne für die Umsetzung der HVF (aktualisiert im Februar 2022, vorbehaltlich Änderungen durch die EMA):
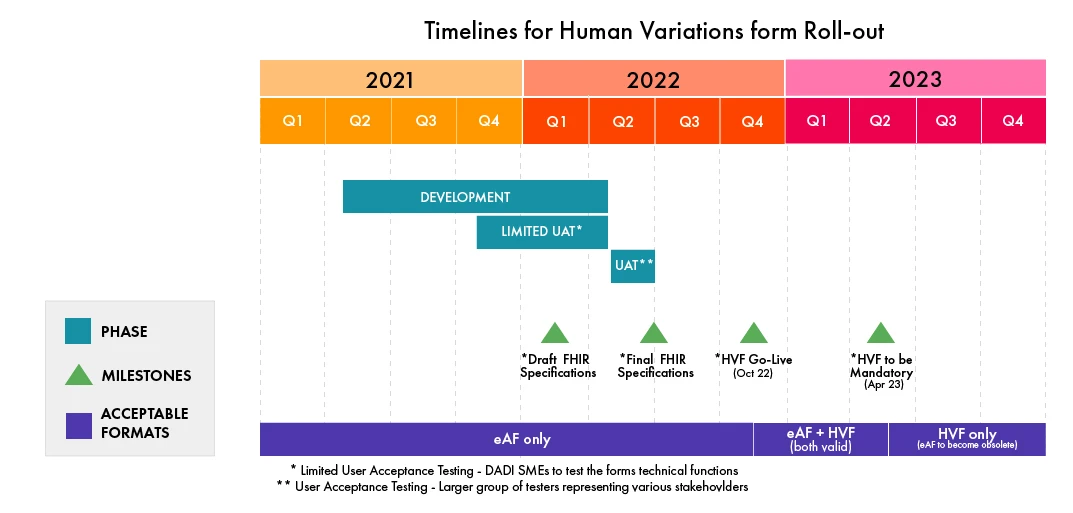
(Quelle: EMA)
Sicherstellung der Anpassungsfähigkeit an das dynamische regulatorische Umfeld
Alle großen Gesundheitsbehörden sind inzwischen dazu übergegangen, qualitativ hochwertige Datensätze und Dokumente einzureichen. Es ist wichtig, dass die Organisationen dies in einem einheitlichen System beibehalten.
Von entscheidender Bedeutung ist auch ein klares Verständnis des gesamten Einreichungslebenszyklus - seiner Anforderungen, der damit verbundenen Personen und Prozesse sowie des aktuellen Standorts der Quelldaten durch eine gründliche Bedarfsanalyse. Die Datenbereinigung und -anreicherung muss Priorität haben, wenn die Bewertung einen Bedarf erkennen lässt.
Es ist unerlässlich, über ein Regulatory Information Management System (RIMS) zu verfügen, das sich an sich ändernde Vorschriften und Richtlinien anpasst, flexibel auf die aktuellen Anforderungen des Unternehmens reagiert und den dynamischen regulatorischen Rahmenbedingungen entspricht. Wenn Sie mehr über die Regulatory-Lösungen Freyrerfahren möchten, mit denen Ihr Unternehmen für DADI und weitere Prozessänderungen gerüstet ist, besuchen us Freyr .









