
Die Biowissenschaften sind eine stark regulierte Branche, in der es viele sensible Informationen gibt, die effizient verwaltet werden müssen. Dokumente sind das Rückgrat eines jeden Segments der Biowissenschaften, da sie die Qualität von Prozessen und die Gewährleistung der Sicherheit bestimmen. Das wachsende Dokumentenaufkommen in Unternehmen erhöht die Nachfrage nach der Ablösung traditioneller und manueller Dokumentationsverfahren exponentiell, um Zeit, Aufwand und Fehler zu reduzieren. In solchen Szenarien erhöht das Fehlen eines geeigneten Dokumentenmanagementsystems (DMS) die Wahrscheinlichkeit, dass wichtige Dokumente verlegt und Änderungen nachverfolgt werden, erheblich.
Zu den größten Herausforderungen bei der Verwaltung mehrerer Dokumente gehören die folgenden:
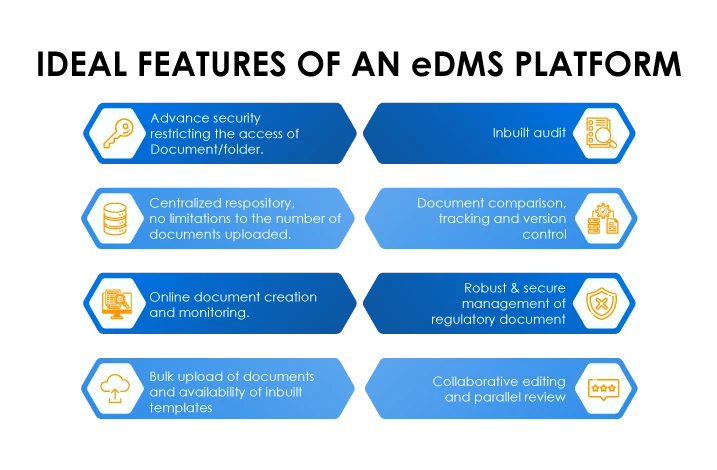
- Begrenzte Sichtbarkeit des Inhalts
- Fehlen von Prüfpfaden
- Notwendigkeit der Zusammenarbeit
- Notwendigkeit von Änderungsverfolgung und Versionskontrolle
- Zeiterfassung Archivierung von Dokumenten
- Uneingeschränkter, aber kontrollierter Zugang zu wichtigen Dokumenten
Ein intelligentes und sicheres elektronisches Dokumentenmanagementsystem (eDMS) kann Präzision und Kontrolle für die komplexe Produktentwicklung bieten. Dank umfassender Content- und Daten-Repositories kann auf Dokumente aus verschiedenen Funktionsbereichen ohne zusätzlichen Aufwand oder Doppelarbeit zugegriffen werden. Ein robustes Content-Repository kann helfen, die Daten aus allen Funktionsbereichen zu verwalten, einschließlich der zuvor entwickelten Dokumentation.
Die offensichtlichen Vorteile eines gut entwickelten eDMS:
- Es hilft, die Konsistenz der Daten zu erhalten und Datenredundanz zu vermeiden.
- Unterstützung des gesamten Lebenszyklus von Dokumenten, von der Konzeption und Erstellung bis zur Einreichung und Archivierung von Zulassungsdokumenten
- eDMS spielt eine wichtige Rolle bei der gemeinsamen Verwaltung von Einreichungsdokumenten an einem Ort, um die Einreichungsbereitschaft zu verbessern
- Es gewährleistet die Sicherheit und Authentizität von Dokumenten und entspricht den Anforderungen von 21 CFR part 11, wodurch Unternehmen von den Vorteilen papierloser Aufzeichnungssysteme profitieren können.
- Es unterstützt die Zusammenstellung von Ordnerstrukturen im eCTD-Format gemäß den Standards der FDA den lokalen Ländervorgaben einer gleichwertigen Behörde.
- Verbessert Aktualität, Dokumentenerstellung und -erfassung
- Es ermöglicht erweiterte Verwaltungsfunktionen zur Verwaltung von Benutzern und zur Überwachung von Aktivitäten vor Ort
- Sicherstellung der Einhaltung der globalen HA durch eine effektive Organisation der Dokumente in Verbindung mit einem effizienten Dokumentenüberwachungsprozess
- Effiziente Klassifizierung und Speicherung aller wichtigen Dokumente mit zuverlässigen Backups
Ein eDMS ermöglicht Teams die Zusammenarbeit und verschafft ihnen einen Überblick über globale regulatorische Abläufe. Freyr rDMS, ein end-to-end System zur Verwaltung regulatorischer Dokumente (rDMS/eDMS), wurde speziell dafür entwickelt, dass regulatorische Gruppen und Abteilungen innerhalb eines Life-Science-Unternehmens mühelos regulatorische Daten und Dokumente erstellen, erfassen, verwalten, organisieren, verknüpfen, bereitstellen und archivieren können. Die Lösung wurde von Grund auf unter Berücksichtigung regulatorischer Strategien und operativer Funktionen entwickelt.
Reach an Freyr , um mehr über elektronische Dokumentenmanagementsysteme zu erfahren. Klicken Sie hier, um sich unsere bewährte Software anzusehen – Freyr . Fordern Sie eine Demo an.









