
Die Einführung von eCTD 4.0 ist ein entscheidender Schritt zur Modernisierung der Zulassungsanträge weltweit. Angesichts der Vorteile wie einer verbesserten Dokumentenverfolgung und metadata Effizienzsteigerungen ist es nicht verwunderlich, dass Behörden weltweit diesen Wandel begrüßen.
Aber wo EMA ? Im Gegensatz zur FDA, die klare Umsetzungsphasen festgelegt hat, EMA einen eher zurückhaltenden Ansatz und beginnt mit Pilotprogrammen und technischen Bewertungen. In diesem Blogbeitrag erläutern wir die Pläne EMAfür eCTD 4.0, die möglichen Auswirkungen auf Zulassungsanträge und wie Ihr Unternehmen die Nase vorn behalten kann.
Noch wichtiger ist die Frage: Hat EMA eCTD 4.0 bereits EMA ? Lassen Sie uns einen Blick darauf werfen.
Was ist eCTD 4.0 und wie unterscheidet es sich von eCTD 3.2.2?
Das Electronic Common Technical Document (eCTD) ist das international anerkannte Format für Zulassungsanträge. Es standardisiert die Art und Weise, wie pharmazeutische Unternehmen Arzneimittelanträge einreichen und Aktualisierungen des Lebenszyklus auf verschiedenen Märkten verwalten.
Die aktuelle Version, eCTD 3.2.2, ist seit Jahren im Einsatz. Allerdings arbeiten Aufsichtsbehörden, darunter auch EMA, an der Entwicklung von eCTD 4.0, das auf dem Standard „Health Level 7 (HL7) Regulated Product Submission (RPS)” basiert. Diese Aktualisierung verbessert die Effizienz der Einreichung und das Management des regulatorischen Lebenszyklus.
Die wichtigsten Unterschiede zwischen eCTD 3.2.2 und eCTD 4.0:
- Besseres Lebenszyklus-Management: Bessere Verfolgung von Dokumentversionen, weniger Duplikate.
- Flexiblere Granularität: Ermöglicht die Wiederverwendung strukturierter Dokumente über verschiedene Einreichungen hinweg.
- Verbesserte Metadata : Strukturiertere metadata für reibungslosere Interaktionen mit Aufsichtsbehörden.
- Größere Interoperabilität: Entwickelt, um besser mit den sich weltweit entwickelnden digitalen Regulierungssystemen zusammenzuarbeiten.
- Obwohl diese Änderungen zahlreiche Vorteile bieten, erfordert der Übergang zu eCTD 4.0 Vorbereitung, Investitionen und ein Verständnis für die Erwartungen der Regulierungsbehörden.
Die Haltung EMAzur Einführung von eCTD 4.0
Die große Frage, die sich alle stellen, lautet: Hat EMA eCTD 4.0 EMA ? Die Antwort lautet: noch nicht, aber die Umstellung ist im Gange.
Aktueller Stand von eCTD 4.0 in der EU:
- Ab sofort bleibt eCTD 3.2.2 der verbindliche Standard für Einreichungen in der EU.
- EMA eCTD 4.0 aktiv evaluiert, dessen Verwendung jedoch nicht offiziell vorgeschrieben.
- Die Behörde arbeitet mit anderen Regulierungsbehörden wie der FDA PMDA japanischen PMDA zusammen, um globale Standards zu vereinheitlichen.
- Es wurden keine offiziellen Übergangsfristen festgelegt, aber EMA angedeutet, dass eCTD 4.0 letztendlich verbindlich werden wird.
Der Ansatz EMA: Schrittweise Einführung mit einem Pilotprogramm
Im Gegensatz zur USFDA, die einen stufenweisen Umsetzungsplan vorgelegt hat, EMA einen strukturierten Ansatz. Die Behörde hat ein technisches Pilotprogramm gestartet, um die Umsetzung von eCTD 4.0 gemeinsam mit Branchenakteuren zu testen.
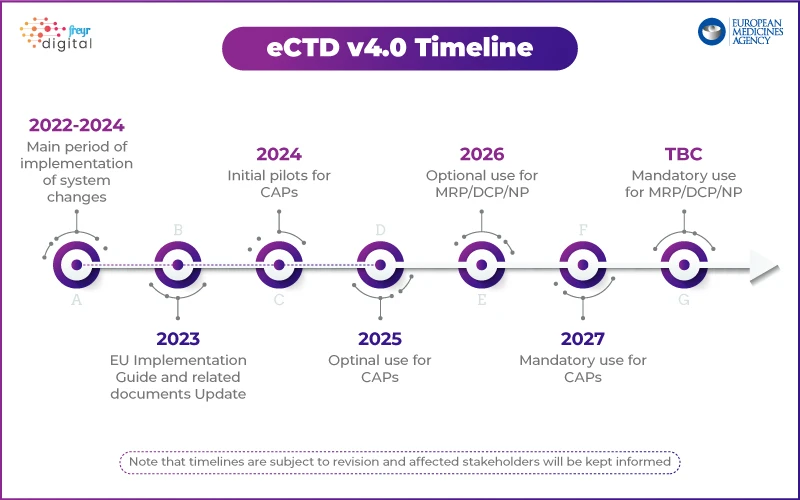
Die wichtigsten Punkte der eCTD 4.0-Strategie EMA:
- Schritt 1: Konzentration auf die technische Interoperabilität mit Regulierungsinstrumenten.
- Zukünftige Phasen: Mock Submissions, Lifecycle Management und gruppierte Submissions.
- Entwurf eines Implementierungspakets mit kontrollierten Vokabularen und Validierungskriterien verfügbar.
EMA für einen reibungslosen Übergang ein, und Life-Science-Unternehmen sollten die aktuellen Informationen auf der offiziellen EMA -Seite verfolgen.
Herausforderungen und Überlegungen für Biowissenschaftsunternehmen
eCTD 4.0 bietet zwar eindeutige Vorteile, aber die Einführung ist nicht ohne Herausforderungen. Hier sind einige wichtige Überlegungen für Pharma- und Biotech-Unternehmen:
- Regulatorische Komplexität
- Der schrittweise Übergang EMA bedeutet, dass Unternehmen auf doppelte Einreichungsverfahren (eCTD 3.2.2 und eCTD 4.0) vorbereitet sein müssen.
- Für die verschiedenen Regionen gelten unterschiedliche Einführungsfristen, so dass die Unternehmen flexibel bleiben müssen.
- Technische Herausforderungen
- Die Datenmigration von eCTD 3.2.2 auf 4.0 erfordert eine sorgfältige Planung.
- Die Validierungsvorschriften werden sich erheblich ändern, so dass aktualisierte Software und Werkzeuge erforderlich sind.
- Unternehmen müssen in Automatisierung und KI-gesteuerte Lösungen investieren, um die Einhaltung der Vorschriften zu gewährleisten.
- Compliance-Risiken
- metadata fehlerhafte metadata oder die Nichteinhaltung neuer Anforderungen an die Dokumentengranularität kann zur Ablehnung der Einreichung führen.
- Die Regulierungsteams müssen angemessen geschult werden, um die neuen Validierungsregeln zu verstehen.
- Auswirkungen auf bestehende Arbeitsabläufe
- Die Unternehmen müssen ihre internen Prozesse anpassen, um eCTD 4.0 gerecht zu werden.
- Eine verstärkte Zusammenarbeit zwischen Regulierungs-, IT- und Einreichungsteams wird notwendig sein.
Die wichtigste Erkenntnis? Unternehmen müssen jetzt mit den Vorbereitungen beginnen, auch wenn EMA eCTD 4.0 noch nicht vorgeschrieben EMA .
Wie sich Unternehmen auf die Umstellung auf eCTD 4.0 EMAvorbereiten können
Auch wenn EMA offizielle Frist gesetzt EMA , profitieren proaktive Unternehmen von einer frühzeitigen Vorbereitung. Und zwar so:
- Bewertung der aktuellen Einreichungsprozesse
- Ermittlung von Lücken in den bestehenden eCTD 3.2.2 Arbeitsabläufen.
- Bewerten Sie, wie sich die neuen Regeln für das Lebenszyklusmanagement auf laufende Einreichungen auswirken werden.
- Investieren Sie in die richtigen eCTD 4.0-Tools
- Wählen Sie eine Software für die Einreichung von Zulassungsanträgen, die eCTD 4.0-kompatibel ist.
- Stellen Sie sicher, dass die Software die HL7-RPS-Standards und metadata unterstützt.
- Schulung von Regulierungs- und IT-Teams
- Durchführung von Workshops und Schulungen zu den Änderungen von eCTD 4.0.
- Legen Sie Richtlinien für metadata und die Lebenszyklusverfolgung fest.
- Zusammenarbeit mit EMA Branchenkollegen
- Nehmen Sie an den Pilotprogrammen und regulatorischen Konsultationen EMAteil.
- Bleiben Sie über die neuesten Leitlinien und regulatorischen Aktualisierungen EMA auf dem Laufenden.
- Durchführung von Tests und Validierung
- Durchführung interner Testübermittlungen unter Verwendung von eCTD 4.0-Strukturen.
- Identifizieren Sie potenzielle Probleme hinsichtlich der Dokumentgranularität und metadata , bevor EMAendgültiges Mandat erteilt.
Wenn Unternehmen jetzt damit beginnen, können sie einen reibungslosen Übergang sicherstellen, ohne dass es zu Unterbrechungen bei den behördlichen Einreichungen kommt.
Was kommt als Nächstes? Die Zukunft von eCTD 4.0 in Europa
Obwohl der vollständige Zeitplan für den Übergang noch unklar ist, umfasst die langfristige Strategie EMA Folgendes:
- Standardisierung der Einreichungen auf den globalen Märkten, Verbesserung der Konsistenz und Effizienz.
- Verkürzung der Genehmigungsfristen durch bessere Verfolgung des Lebenszyklus von Anträgen.
- Integration von KI und Automatisierung in regulatorische Arbeitsabläufe zur Verbesserung der Compliance.
In den nächsten Jahren können wir mehr Klarheit von EMA erwarten, einschließlich offizieller Zeitpläne für den Übergang und neuer Validierungskriterien.
Schlussfolgerung
EMA eCTD 4.0 zwar noch nicht vorgeschrieben, aber es ist nur eine Frage der Zeit, bis es zum Standard für Zulassungsanträge in der EU wird. Unternehmen, die sich proaktiv darauf vorbereiten, verschaffen sich einen Wettbewerbsvorteil, stellen die Einhaltung der Vorschriften sicher und vermeiden regulatorische Hürden in letzter Minute.
Wichtigste Erkenntnisse
- eCTD 3.2.2 ist nach wie vor der aktuelle Standard, aber eCTD 4.0 steht kurz bevor.
- EMA einen schrittweisen Ansatz und hat noch kein offizielles Mandat.
- Die Unternehmen sollten jetzt mit den Vorbereitungen beginnen, um einen reibungslosen Übergang zu gewährleisten.
- Investitionen in neue Technologien, die Schulung der Teams und die Prüfung der eingereichten Unterlagen werden von entscheidender Bedeutung sein.
Aufruf zum Handeln
Bleiben Sie über die regulatorischen Ankündigungen EMAauf dem Laufenden und beginnen Sie mit der Bewertung Ihrer Bereitschaft für eCTD 4.0. Je früher Sie sich vorbereiten, desto einfacher wird der Übergang sein, wenn die Vorschrift in Kraft tritt.
Benötigen Sie Unterstützung bei der Auswahl einer eCTD 4.0-konformen Software oder möchten Sie wissen, wie sich diese Umstellung auf Ihr Unternehmen auswirkt? Dann reach gerne an us.









