
Die Welt der pharmazeutischen Vorschriften steht mit der Einführung von eCTD 4.0 vor einem großen Update. Dieses standardisierte Format verspricht eine reibungslosere Reise für neue Arzneimittelanträge, die bei den Zulassungsbehörden eingereicht werden. Doch für Unternehmen, die sich ein Stück des 141,5 Milliarden Dollar schweren japanischen Pharmamarktes sichern wollen, gibt es eine entscheidende Neuerung: Japan beschleunigt den Zeitplan für die Einführung!
Nachfolgend eine Analyse dieser Highlights:
- Obligatorische Einführung: Im Gegensatz zu anderen Bereichen, in denen es vor der obligatorischen Einführung freiwillige Phasen gibt, will Japan die Verwendung von eCTD 4.0 bis 2026 verbindlich vorschreiben.
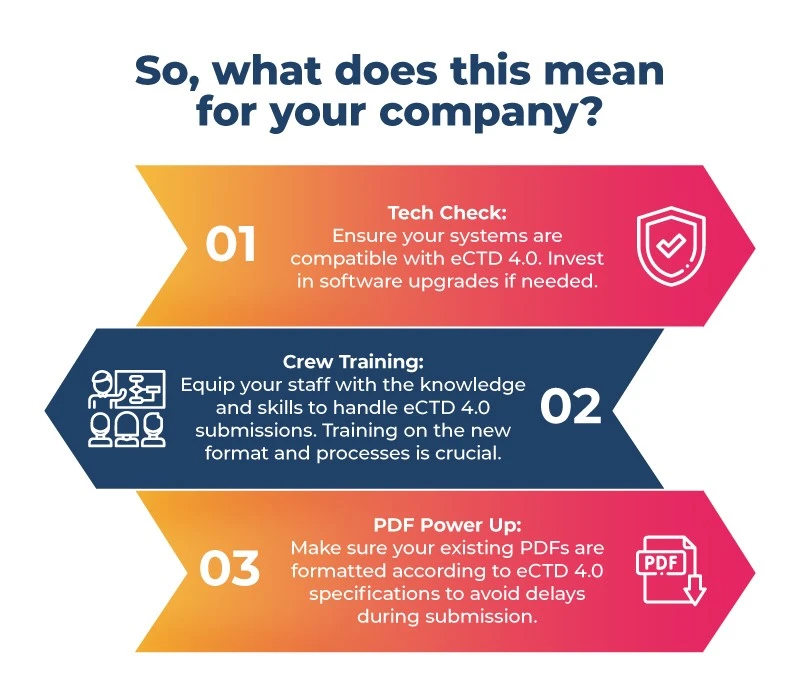
- Vorbereitung ist entscheidend: Aufgrund von Zeitbeschränkungen und dem Fehlen eines direkten Migrationspfads vom japanischen PMDA JP1.0 zu eCTD 4.0 ist eine gute Vorbereitung entscheidend. Die Konzentration auf ein besseres System wird den Pharmaunternehmen in Japan während des Übergangsprozesses helfen. Zu diesen Schritten gehören die Aktualisierung der Software, die Schulung der Mitarbeiter und die Vorbereitung von PDF-Dateien für das neue Format.
- Verfügbare Ressourcen: Die japanische Arzneimittel- und Medizinprodukteagentur (PMDA) hat Ressourcen veröffentlicht, die Unternehmen bei dieser Umstellung unterstützen können, darunterICH Common Technical Document eCTD 4.0 Implementation Guide“ mit Erläuterungen zu den vorgenommenen Änderungen und bewährten Verfahren.
Hier sind einige Gründe, warum Sie sich dieses Zahlenspiel nicht entgehen lassen sollten:
- Schnellweg zu eCTD 4.0: Im Gegensatz zu anderen Regionen, in denen der Prozess schrittweise erfolgt, strebt Japan bereits für 2026 die obligatorische Einführung von eCTD 4.0 an. Das ist drei Jahre vor der vonFDA US FDA 2029 festgelegten Frist! Mit diesem ehrgeizigen Zeitplan hat Japan eine Vorreiterrolle bei der weltweiten Einführung von eCTD übernommen.
- Kein Raum für Fehler: JP konnte im Gegensatz zu seinen Vorgängerversionen nicht direkt in eCTD 4.0 umgewandelt werden. Dies bedeutet, dass Pharmaunternehmen besonders gut vorbereitet sein müssen, um Verzögerungen bei der Einreichung zu vermeiden, die sie Millionen an Einnahmen kosten könnten.
- Hilfreiche Unterstützung für eine reibungslose Einführung: Die japanische Arzneimittel- und Medizinprodukteagentur (PMDA) ist sich dieser Herausforderungen bewusst. Sie hat Ressourcen wie Implementierungsleitfäden entwickelt, die Unternehmen dabei unterstützen sollen, diese Änderungen problemlos umzusetzen und sich erfolgreich auf dem japanischen Markt zu etablieren. (pmda).
Wenn Sie Medikamente für den riesigen japanischen Markt entwickeln, ist es Zeit, sich anzuschnallen! Hier ist Ihre Checkliste vor dem Flug:
Der Übergang zu eCTD 4.0 verspricht mehr Effizienz und globale Standardisierung im gesamten Zulassungsprozess für Arzneimittel. Ihr Unternehmen kann sich auf diese Entwicklung in Japan vorbereiten, um einen reibungslosen Übergang zu gewährleisten und die unzähligen Möglichkeiten dieser neuen era zu nutzen. Denken Sie daran: Wer sich nicht vorbereitet, bereitet sich auf sein Scheitern vor – seien Sie also bereit, mit eCTD 4.0 in Japan durchzustarten.
Die damit verbundenen Vorteile und Chancen sind für die Pharmaindustrie attraktiv. Allerdings gibt es dabei auch einige Schwierigkeiten, die gelöst werden müssen. Um sich nahtlos durch ein sich ständig veränderndes regulatorisches Umfeld zu bewegen, können Unternehmen Partnerschaften mit zuverlässigen Beratern wie Freyr eingehen. Begrüßen Sie die Zukunft der Zulassungsanträge in Japan mit unserer einzigartigen eCTD-Software Freyr SUBMIT PRO, die 21 CFR Part 11 entspricht und über ein flexibles Bereitstellungsmodell verfügt. Kontaktieren us , um mehr zu erfahren und sich auf den Weg zu mehr Effizienz und Erfolg zu begeben. Fordern Sie noch heute eine Demo an.









