
Chinas Pharmaindustrie hat seit seinem Beitritt zur Welthandelsorganisation (WTO) ein beträchtliches Wachstum erlebt. Im Jahr 2021 wird China einen Anteil von 12 % am globalen Pharmamarkt halten und damit den zweitgrößten Beitrag leisten. Nach Angaben der Nachrichtenagentur Xinhua wird der chinesische Pharmamarkt im Jahr 2021 708,75 Mrd. Yuan erwirtschaften, während die inländischen chinesischen Arzneimittelhersteller 502 Mrd. USD an Gewinn erzielen.
Wie Sie vielleicht wissen, hat die Nationale Medizinproduktebehörde (NMPA), die Gesundheitsbehörde Chinas, damit begonnen, eCTD-Zulassungsanträge (MA) sowie Anträge auf klinische Studien (CTAs) anzunehmen, was den Weg für mehr Möglichkeiten ebnet. Dies bringt jedoch auch eine Reihe von Herausforderungen mit sich.
In diesem Blog befassen wir uns mit der Welt der elektronischen Common Technical Document (eCTD)-Einreichungen, die sich in der pharmazeutischen Industrie immer mehr zur bevorzugten Methode für Dokumenteneinreichungen entwickeln.
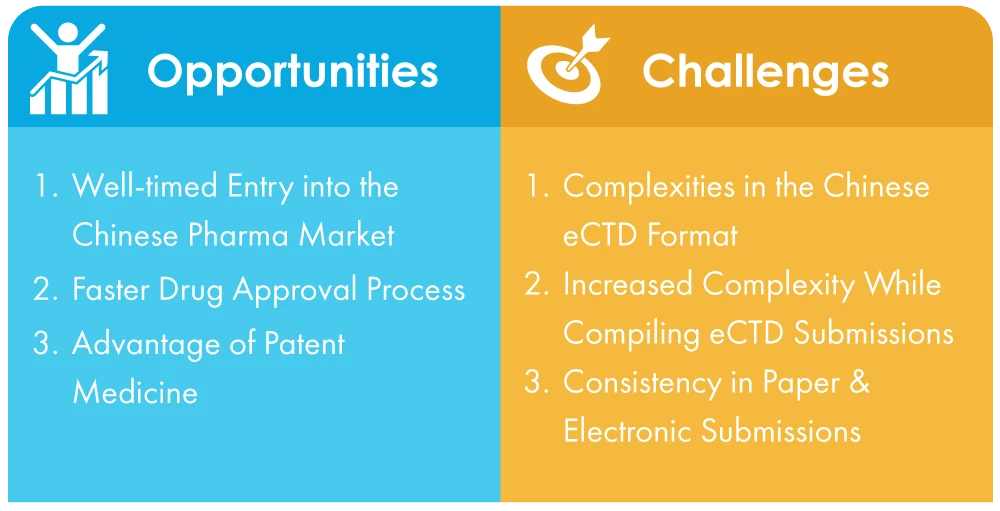
Herausforderungen für Unternehmen in China bei der Anpassung an die obligatorischen eCTD-Einreichungen
- Die Komplexität des chinesischen eCTD-Formats: Im Gegensatz zum universellen Standard, der recht einfach ist, ist das chinesische eCTD-Format kompliziert und kann für Unternehmen, die mit dem Verfahren nicht vertraut sind, schwierig zu handhaben sein. Dies kann zu Rückschlägen bei der Vorlage der wesentlichen Nachweise führen.
- Erhöhte Komplexität bei der Erstellung von eCTD-Einreichungen: NMPA, die chinesische Gesundheitsbehörde, hat neue Regeln und Vorschriften eingeführt, um den Übergang zu elektronischen Einreichungen zu unterstützen, aber von den Unternehmen wird weiterhin erwartet, dass sie sich in einem komplexen und dynamischen Umfeld zurechtfinden. Dies kann für Unternehmen, die nicht vor Ort vertreten sind oder das regulatorische Umfeld in China nicht genau kennen, eine größere Herausforderung darstellen.
- Mehrsprachige Unterstützung bei der Einreichung von Anträgen auf Papier und in elektronischer Form: Die Dokumente müssen in Mandarin mit englischen Versionen als Referenz eingereicht werden, was für Unternehmen, die nicht mit qualifizierten Übersetzern zusammenarbeiten, eine schwierige Aufgabe sein kann.
Möglichkeiten bei der Umstellung von Papier auf papierlose Einreichungen
- Rechtzeitiger Eintritt in den chinesischen Pharmamarkt: Der Eintritt in den chinesischen Markt ist dank der umwälzenden Reformen und politischen Neuerungen einfacher geworden. Eine der wichtigsten Änderungen ist die Einführung der elektronischen Einreichung von Anträgen, die den Prozess rationalisiert und viele der Herausforderungen beseitigt, mit denen Unternehmen früher konfrontiert waren. Dies ist ein Beweis für Chinas Engagement zur Förderung von Strukturanpassungen, Verfahrensumstellungen und des allgemeinen Marktwachstums.
- Schnelleres Arzneimittelzulassungsverfahren: Da die Einreichungen nun elektronisch erfolgen, wird das Zulassungsverfahren für Arzneimittel viel schneller ablaufen, so dass die Markteinführung von Medikamenten reibungsloser und schneller vonstatten gehen wird. Dies wird den großen Pharmaunternehmen letztlich helfen, den Anteil Chinas am globalen Pharmamarkt weiter zu erhöhen.
- Vorteil der Patentmedizin: Die Patentmedizin ist das zweitgrößte Produktsegment mit großen Gewinnspannen. Die Herstellung von Originalpräparaten ist jedoch mit langen Rückgabefristen, steigenden F&E-Kosten und langwierigen F&E-Zeiten verbunden. Mit der Einführung der elektronischen Einreichung können all diese Hindernisse beseitigt werden. Ab 2022 sind ausländische Unternehmen immer noch die Hauptakteure auf diesem Markt. Dies macht diesen Markt zu einem Nischenmarkt für dieses Segment.
Wie kann man sich auf diese neue Umsetzung in China vorbereiten?
Die Umstellung auf obligatorische eCTD-Einreichungen in China bietet Unternehmen, die auf dem weltweit größten Pharmamarkt wettbewerbsfähig bleiben wollen, eine Fülle von Möglichkeiten. Durch die Zusammenarbeit mit dem richtigen Experten können Unternehmen die sich ständig weiterentwickelnde Regulierungslandschaft mit Leichtigkeit und Zuversicht navigieren. Um der Konkurrenz einen Schritt voraus zu sein, ist es entscheidend, über eine Tochtergesellschaft mit lokaler Präsenz und Kenntnissen der HA-Vorschriften zu verfügen. Freyr SUBMIT PRO, eine Software für die Veröffentlichung und Einreichung von Dokumenten, hilft Herstellern, problemlos in den chinesischen Pharmamarkt einzusteigen. Um mehr über das Tool zu erfahren, fordern Sie eine Demo an.









