
Die Idee der elektronischen Einreichung von Zulassungsanträgen für Arzneimittel ist älter als das eCTD-Tool selbst. Ende der 1980er Jahre wurden Initiativen wie CANDA (Computer-Aided New Drug Application) von der US FDA Food and Drug Administration) und europäischen Behörden geprüft. Diese frühen Bemühungen zielten darauf ab, die Effizienz und den Datenzugriff für Prüfer zu verbessern.
Einführung des eCTD-Standards (2003):
Die Internationale Konferenz zur Harmonisierung (ICH) hat 2003 mit einer bahnbrechenden Neuerung reagiert: dem eCTD-Standard (electronic Common Technical Document). Dieses standardisierte Format wurde entwickelt, um eine universelle Sprache für elektronische Einreichungen weltweit zu etablieren.
Das Aufkommen von eCTD-Tools:
Mit der Verabschiedung des eCTD-Standards stieg die Nachfrage nach speziellen eCTD-Tools sprunghaft an. Diese Tools brachten mehrere wichtige Vorteile mit sich:
- Rationalisierte Inhaltserstellung: Die Benutzer können mühelos Dokumente in Übereinstimmung mit der eCTD-Struktur erstellen und organisieren.
- Robuste Validierung: eCTD-Tools stellten sicher, dass die Einreichungen den technischen Spezifikationen entsprachen, und verhinderten Verzögerungen durch Formatierungsfehler.
- Effizientes Lebenszyklus-Management: Die Verwaltung von Revisionen, die Nachverfolgung von Versionen und die Einhaltung gesetzlicher Vorschriften werden einfacher.
Diese Innovationen haben den Prozess der Einreichung von Zulassungsanträgen revolutioniert und ihn effizienter und zuverlässiger gemacht.
Wie die Software Freyr die Erstellung von eCTD-Dateien automatisiert
Die fortschrittliche Softwarelösung Freyr PRO Freyr begegnet diesen Herausforderungen, indem sie wichtige Aspekte der eCTD-Erstellung automatisiert und so die Effizienz steigert und menschliche Fehler reduziert.
Optimierung der Ressourcen: Durch die Automatisierung sich wiederholender Aufgaben setzt unsere Software wertvolle Personalressourcen frei. Die Fachleute können sich auf strategischere und hochwertigere Aktivitäten konzentrieren, z. B. auf die Datenanalyse, die Entwicklung von Regulierungsstrategien und die Einbeziehung von Interessengruppen. Diese Verlagerung steigert nicht nur die Produktivität, sondern senkt auch die Betriebskosten und sorgt so für eine erhebliche Investitionsrendite.
Minimiertes Risiko menschlicher Fehler: Die Automatisierung minimiert das Risiko menschlicher Fehler, indem sie sicherstellt, dass die Daten korrekt übertragen und die Dokumente richtig formatiert werden. Die in der Software integrierten Validierungsprüfungen und Fehlererkennungsmechanismen verbessern die Qualität und Konformität von Zulassungsanträgen weiter. Dies reduziert den Bedarf an Nacharbeit und trägt dazu bei, dass Genehmigungen rechtzeitig erteilt werden.
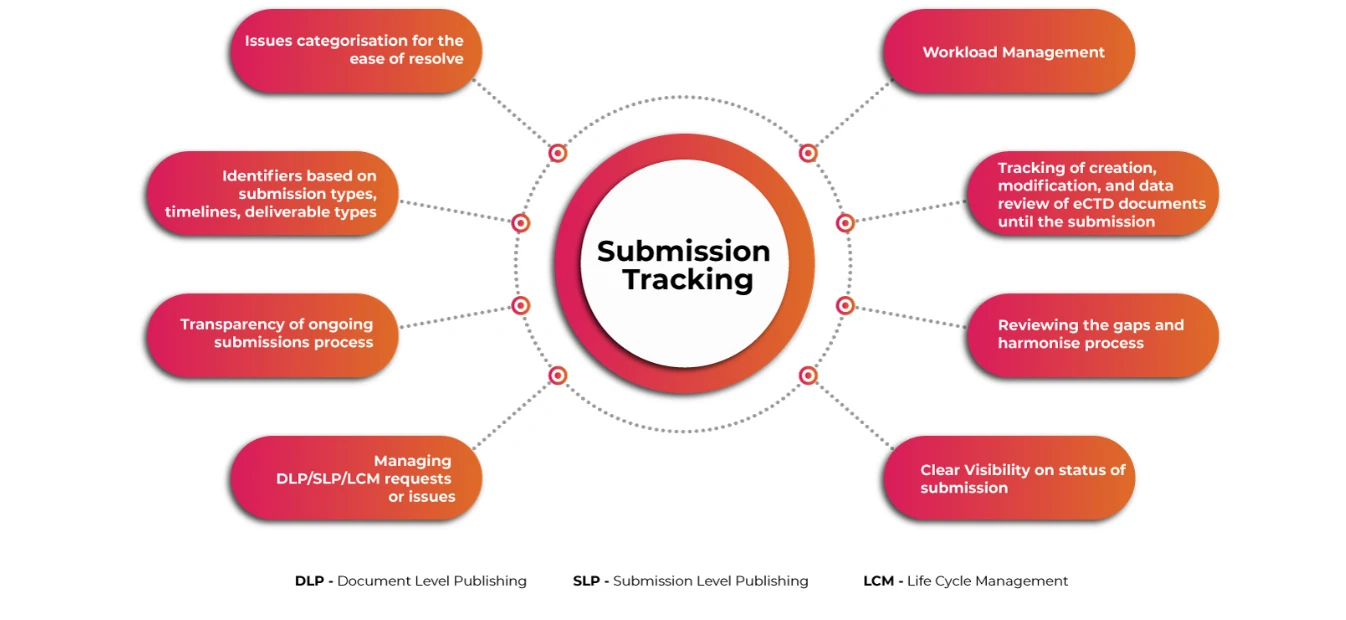
Submissions Tracker für einen umfassenden Überblick über eCTD-Einreichungen
Ein benutzerfreundliches automatisiertes System zur Planung und Verfolgung komplexer globaler eCTD-Einreichungsaktivitäten, zur Verwaltung von Arbeitsabläufen und zur Speicherung und Verwaltung von Zulassungsanträgen und Einreichungsinformationen ist ein Muss, damit Antragsteller die damit verbundenen Herausforderungen rechtzeitig bewältigen können. Der Einblick in die Einreichungs- und Veröffentlichungsvorgänge auf granularer Ebene macht den gesamten Prozess der Einreichung reibungsloser und schneller.
Verfolgung der Einreichung
Die neueste Aktualisierung von eCTD
Die Umstellung auf eCTD 4.0 verspricht mehr Effizienz und eine globale Standardisierung im Zulassungsverfahren für Arzneimittel. Durch eine frühzeitige Vorbereitung auf diesen Übergang kann Ihr Unternehmen den Wandel nahtlos bewältigen und die zahlreichen Chancen dieser neuen era nutzen. Die Umstellung auf eCTD 4.0 mag zwar Herausforderungen era bringen, diese sind jedoch mit Engagement und Entschlossenheit aller beteiligten Länder zu bewältigen. Auch wenn erhebliche Investitionen und Anstrengungen erforderlich sein werden, lohnen sich diese aufgrund der erheblichen Vorteile von eCTD 4.0 auf jeden Fall.
Überarbeitung des Einreichungsprozesses: eCTD 4.0 verspricht, die Art und Weise zu revolutionieren, wie Pharmaunternehmen Daten zur Arzneimittelentwicklung bei den Gesundheitsbehörden einreichen. Ziel ist es, den Einreichungsprozess zu rationalisieren.
Zeitplan für die Umsetzung: Die FDA , ab 2024 neue Anträge im eCTD 4.0-Format anzunehmen. In zukünftigen Phasen werden bestehende v3.2.2-Anträge und die bidirektionale Kommunikation behandelt.
Vorwärtskompatibilität: eCTD 4.0 beinhaltet Vorwärtskompatibilität, die die Wiederverwendung von Inhalten der Version 3.2.2 im Lebenszyklus und im Dokument ermöglicht. Dies vereinfacht die Konvertierung von v3.2.2-Anwendungen zu eCTD 4.0.
Validierungskriterien: Spezifikationen für eCTD 4.0-Validierungskriterien sind verfügbar. Diese Kriterien gewährleisten die Qualität und Genauigkeit der Einreichungen.
Globale Einhaltung: Bis 2026 könnten die Regulierungsbehörden weltweit die Einhaltung der eCTD-4.0-Normen verlangen. Während die Einhaltung derzeit noch freiwillig ist, wird die Durchsetzung zwischen 2026 und 2029 beginnen.
Die Zukunft von eCTD:
Sie müssen KI begrüßen und Ihre Regulierungsfunktion dynamisch gestalten, da sie einen Mehrwert für Ihr Unternehmen darstellt. Freya Fusion ist eine hochmoderne, KI-gesteuerte, cloud-native Plattform für das Regulatory Information Management (RIM), die außergewöhnliche Leistung, Sicherheit und Skalierbarkeit bietet und gleichzeitig strenge GxP-Konformität gewährleistet. Freya Fusion wurde mit fortschrittlichenML Automatisierungsfunktionen erweitert und Freya Fusion im digitalen Bereich Freya Fusion überlegene Funktionalität und eine hervorragende Benutzererfahrung Freya Fusion . Die KI-Fortschritte von Freyr versprechen Module für die Erstellung und Nachverfolgung von Einreichungen, die Funktionen für die nahtlose Zusammenstellung, Veröffentlichung und Validierung von regulatorischen Einreichungen umfassen und eine sorgfältige Einhaltung der eCTD-Richtlinien gewährleisten. Mit KI-gestütztem SaaS im Bereich der Einhaltung gesetzlicher Vorschriften die Nase vorn zu haben, wird Ihrem Unternehmen mit Sicherheit zugutekommen. Ob Frühwarnsystem für regulatorische Änderungen, optimierte Überprüfung und Analyse von regulatorischen Dokumenten oder prädiktive Analysen für das Risikomanagement – Freyr bietet Ihnen alles, was Sie brauchen. Reach anhello@freyrdigital.com, um mehr über unsereML Innovationen zur Optimierung regulatorischer Abläufe in der Medizinbranche zu erfahren.
Bleiben Sie mit regelmäßigen Updates und technologischen Fortschritten immer auf dem neuesten Stand. Arbeiten Sie mit us zusammen, us Ihre regulatorischen Abläufe zu optimieren, die Produktivität zu steigern und die Qualität Ihrer Einreichungen zu verbessern. Fordern Sie noch heute eine Demo an und erleben Sie die perfekte Kombination aus Fachwissen und Tools. Bringen Sie Ihr Unternehmen von gut zu großartig. Kontaktieren Sie us noch heute.









