
KI ist das neue Schlagwort, und es sieht nicht so aus, als würde sein Hype in nächster Zeit nachlassen. Wir alle wissen, dass künstliche Intelligenz (KI) und Machine Learning ML) eine transformative Kraft in verschiedenen Branchen sind, und der medizinische Sektor bildet da keine Ausnahme. In den letzten JahrenML bedeutende Fortschritte bei der Revolutionierung der Regulierungsabläufe in der Medizinbranche gemacht. Regulierungsbehörden weltweit nutzen das Potenzial vonML Prozesse zu rationalisieren, die Entscheidungsfindung zu verbessern und die allgemeine Qualität der Gesundheitsversorgung zu steigern. Lassen Sie uns untersuchen, wieML die Regulierungsabläufe im medizinischen Bereich verändernML und welche Richtlinien die Regulierungsbehörden für diesen technologischen Fortschritt festgelegt haben.
Die Rolle vonML regulatorischen Betrieb
Künstliche Intelligenz bietet eine vielversprechende Lösung für die regulatorischen Herausforderungen. Hier erfahren Sie, wieML die regulatorischen Abläufe in der Medizinbranche verändernML :
- Fundierte Entscheidungsfindung durch Datenanalyse und Prognosemodellierung. KI-Algorithmen können große Datensätze schnell verarbeiten und ermöglichen es den Regulierungsbehörden, Trends, potenzielle Risiken und Anomalien effektiver zu erkennen. Die prädiktive Modellierung kann dazu beitragen, die Sicherheit und Wirksamkeit von Arzneimitteln mit größerer Genauigkeit zu bewerten, indem manuelle Fehler vermieden werden.
- Die Automatisierung von Routineaufgaben ermöglicht es den Regulierungsbehörden, sich auf strategischere Aufgaben zu konzentrieren. KI-gestützte Automatisierung kann Routineaufgaben der Regulierungsbehörden wie Dateneingabe, Dokumentenprüfung und Compliance-Überwachung rationalisieren, das Fehlerrisiko verringern und die Prozesse beschleunigen.
- Eine verbesserte Überwachung der Einhaltung von Vorschriften stellt sicher, dass die Regulierungsbehörden auf dem neuesten Stand sind. KI kann Daten kontinuierlich auf die Einhaltung von Vorschriften und Standards überwachen, Abweichungen oder potenzielle Probleme in Echtzeit aufzeigen und das Risiko von Produktrückrufen oder Verstößen gegen Vorschriften verringern.
- Die Arzneimittelforschung und -entwicklung sorgt dafür, dass die Aufsichtsbehörden lebensrettende Medikamente schneller und kostengünstiger auf den Markt bringen können. KI-gestützte Arzneimittelforschung kann den Entwicklungsprozess erheblich beschleunigen, was zu schnelleren Zulassungen und geringeren Entwicklungskosten führen kann. ML können biologische Daten analysieren, potenzielle Wirkstoffkandidaten identifizieren und deren Wirksamkeit vorhersagen, wodurch sich der Zeit- und Kostenaufwand für die Markteinführung neuer Medikamente erheblich reduziert.
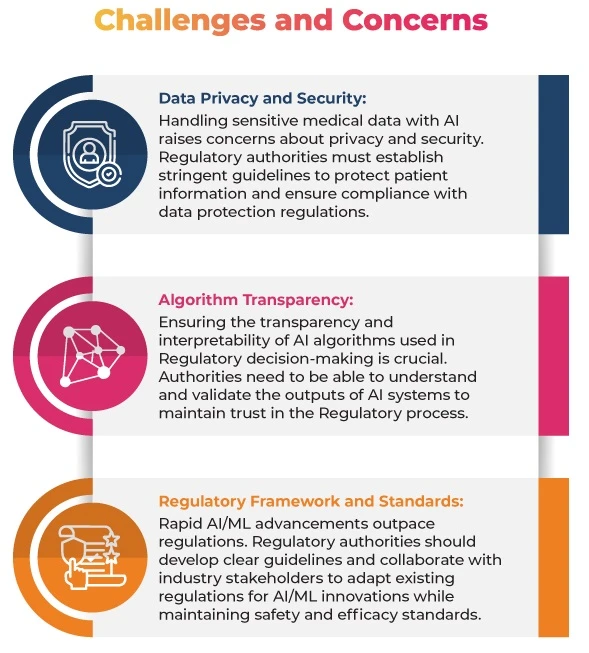
Leitlinien der Regulierungsbehörde
Um diesen Bedenken Rechnung zu tragen, haben die Regulierungsbehörden bereits einige Leitlinien und Rahmenbedingungen für den Einsatz vonML medizinischen Bereich herausgegeben:
FDA: Leitlinien zuML Medizinprodukten: Die FDA Leitlinien FDA , die den regulatorischen Rahmen für KI- und ML Software as a Medical Device SaMD) umreißen. Diese Leitlinien enthalten Empfehlungen für die Entwicklung, Bewertung und Validierung von SaMDs, einschließlich der Verwendung von Leistungsüberwachung in der Praxis, Protokollen für Algorithmusänderungen und Qualitätssicherungssystemen. Ziel ist es, die Sicherheit und Wirksamkeit vonML Medizinprodukten zu gewährleisten und gleichzeitig Innovation und Entwicklung in diesem wichtigen Bereich zu fördern.
EMA: Der Einsatz künstlicher Intelligenz (KI) im Lebenszyklus von Arzneimitteln: Dieses Reflexionspapier befasst sich mit dem Einsatz vonML gesamten Lebenszyklus von Arzneimitteln, wobei der Schwerpunkt auf Sicherheit und Wirksamkeit liegt. Es soll regulatorische Leitlinien für den sich rasch entwickelndenML bereitstellen und konzentriert sich dabei auf die wissenschaftlichen Grundsätze, die für die Bewertung dieser Technologien in den Phasen der Arzneimittelentwicklung, -zulassung und -nachzulassung erforderlich sind.
MHRA: Leitfaden zu Software und KI als Medizinprodukt: Die britische Arzneimittelzulassungsbehörde (MHRA) hat einen Leitfaden zuML medizinischer Software veröffentlicht. Darin werden die regulatorischen Erwartungen anML SaMD dargelegt und die Bedeutung von Datenqualität und Risikomanagement hervorgehoben.
Der Einzug vonML die Medizinbranche verändert die Regulierungsabläufe und macht sie effizienter, datengesteuerter und anpassungsfähiger. Dies hat das Potenzial, Prozesse zu rationalisieren, Compliance-Kosten zu senken, die Arzneimittelentwicklung zu beschleunigen und letztlich die Ergebnisse im Bereich der öffentlichen Gesundheit zu verbessern. Dieser transformative Wandel muss jedoch sorgfältig durchgeführt werden, wobei der Schwerpunkt auf Validierung, Ethik und Zusammenarbeit liegen muss, um das Vertrauen der Regulierungsbehörden zu gewinnen. AngesichtsML WeiterentwicklungML wird es spannend sein, die anhaltende Transformation der pharmazeutischen Regulierungsprozesse und ihre positiven Auswirkungen auf die Patientensicherheit und Innovation in diesem Bereich zu beobachten.
Reach hello@freyrdigital.com, um mehr über unsereML Innovationen zu erfahren, die die regulatorischen Abläufe in der Medizinbranche optimieren. Kontaktieren Sie us noch heute.









