
In der dynamischen Welt der Pharmazeutika spielen Real-World-Daten (RWD) und Real-World-Evidence (RWE) eine immer wichtigere Rolle. Diese Instrumente schlagen eine Brücke zwischen der kontrollierten Umgebung klinischer Studien und den komplexen Realitäten der Patientenversorgung. Mehrere Pharmaunternehmen haben RWD/RWE erfolgreich zur Unterstützung ihrer Zulassungsanträge eingesetzt. So erhielt Bristol Myers Squibb beispielsweise im Jahr 2022 FDA für die Verwendung von Opdivo (Nivolumab) in Kombination mit Yervoy (Ipilimumab) zur Behandlung von metastasiertem Melanom in der Erstlinienbehandlung auf der Grundlage von RWE-Daten aus der CheckMate 151-Studie.
Mit dem jüngsten FDA Leitlinie vom Oktober 2023, der den Weg ebnet, ist es an der Zeit, dass pharmazeutische Innovatoren das Potenzial von RWD und RWE für Zulassungsanträge nutzen.
RWD/RWE kann zur Unterstützung einer Vielzahl von Zulassungsanträgen verwendet werden, darunter:
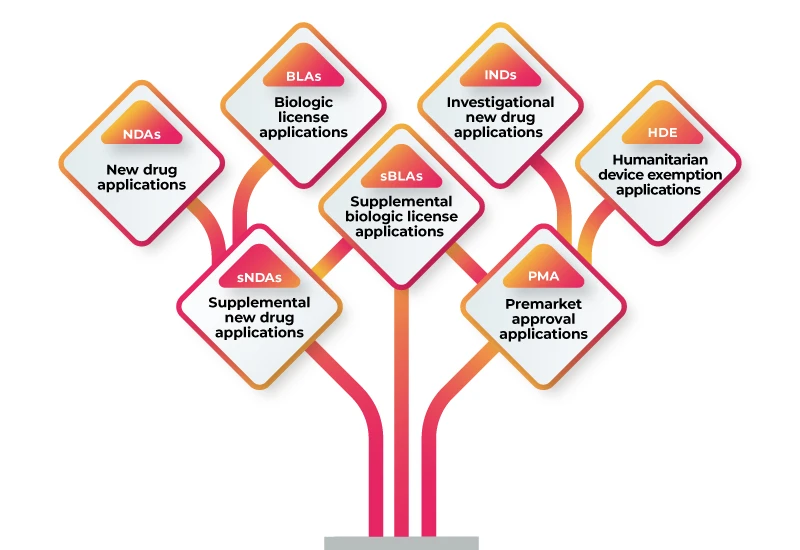
Um RWD/RWE zur Unterstützung Ihres Zulassungsantrags zu verwenden, sollten Sie die folgenden Schritte befolgen:
Schritt 1: Definieren Sie Ihre regulatorische Frage
Beginnen Sie Ihre Reise, indem Sie die zentrale regulatorische Frage ermitteln, die Sie beantworten wollen. Ganz gleich, ob es sich um Sicherheit, Wirksamkeit oder Leistung in realen Szenarien handelt, es ist wichtig, dass Sie sich über Ihr Ziel im Klaren sind.
Schritt 2: Auswahl hochwertiger RWD-Quellen
Qualität ist hier der Schlüssel. Wählen Sie RWD-Quellen, die direkt mit Ihrer Fragestellung korrelieren. Elektronische Gesundheitsakten, Daten über medizinische Ansprüche und Patientenregister sind unschätzbare Ressourcen.
Schritt 3: Entwerfen Sie ein solides Studiendesign
Ihr Studiendesign sollte Ihre regulatorische Fragestellung widerspiegeln und den regulatorischen Richtlinien entsprechen. Ihr Ansatz muss mit den Erwartungen FDA übereinstimmen.
Schritt 4: Analyse und Generierung von RWE
Verwenden Sie solide statistische Methoden für Ihre Analyse. Eine klare Dokumentation ist wichtig, um Transparenz und Glaubwürdigkeit zu gewährleisten.
Schritt 5: Interpretieren und präsentieren Sie Ihre Ergebnisse
Objektivität ist der Eckpfeiler der RWE-Dolmetschung. Ihre Präsentation sollte auf Ihr Publikum zugeschnitten sein und die Gesamtheit der Beweise mit Präzision vermitteln.
Hier sind einige Tipps für die Verwendung von RWD/RWE zur Unterstützung Ihrer Zulassungsanträge:
- Ergänzen, nicht ersetzen: Klinische Studien: RWD/RWE verbessern die Sicherheits- und Wirksamkeitsnachweise, ersetzen aber keine gut konzipierten klinischen Studien.
- Transparente Beschränkungen: Erkennen Sie den Beobachtungscharakter von RWD/RWE, mögliche Verzerrungen und unkontrollierte Störfaktoren an.
- Zusammenarbeit mit Aufsichtsbehörden: Arbeiten Sie eng mit den Aufsichtsbehörden zusammen, um Ihre RWD/RWE-Nutzung mit deren Erwartungen in Einklang zu bringen.
Wenn Sie diese Schritte und Tipps befolgen, können Sie RWD/RWE nutzen, um Ihren Zulassungsantrag zu unterstützen und Ihr Produkt schneller und effizienter auf den Markt zu bringen.
Wenn Sie sich auf diese RWD- und RWE-Reise begeben, denken Sie daran, dass Sie den Weg für effizientere und fundiertere Zulassungsanträge ebnen. Die Zukunft der pharmazeutischen Innovation liegt in der realen Welt der Evidenz. Nehmen Sie sie an, machen Sie sie sich zunutze und setzen Sie sich in der Branche durch.
Sind Sie bereit, Ihren Prozess zur Einreichung von Zulassungsanträgen zu optimieren? Entdecken Sie unsere hochmoderne Software für die Einreichung von Zulassungsanträgen Freyr PRO !









