
Ein Validierungsprotokoll ist definiert als ein dokumentierter Plan für die Prüfung eines Medizinprodukts, um zu bestätigen, dass der zur Herstellung des Produkts verwendete Produktionsprozess die spezifischen Anforderungen der Anwender, der Technik und der Regulierungsbehörden erfüllt. Dies beinhaltet eine Überprüfung der Prozessvariablen und Betriebsgrenzen sowie die Analyse der Testergebnisse unter tatsächlichen Einsatzbedingungen.
Der Validierungsprozess umfasst mehrere konkrete Maßnahmen. Die Schritte werden im Folgenden erläutert:
- Zunächst wird das Validierungsteam gebildet, und jedem Mitglied werden bestimmte Aufgaben und Verantwortlichkeiten zugewiesen. Der Zweck der Prozessvalidierung besteht darin, eine klare Aussage über die Validierungsziele zu machen und den Umfang der Validierungsaktivitäten zu definieren, indem die zu validierenden Aspekte des Medizinprodukts festgelegt werden. Das Team macht sich dann mit den zugrundeliegenden Prinzipien des Prozesses vertraut, um spezifische Parameter und gewünschte Ergebnisse zu ermitteln.
- Zweitens werden die Bewertungs- und Akzeptanzkriterien sowie die Auswahl geeigneter Prüfmethoden, Werkzeuge und statistischer Analyseverfahren festgelegt. Anschließend werden Prozessvalidierungsprotokolle erstellt und die Installationsqualifizierung (IQ), die Betriebsqualifizierung (OQ) und die Leistungsqualifizierung (PQ) durchgeführt.
- Schließlich werden laufende Prozesskontrollen und Überwachungsmaßnahmen festgelegt, um die kontinuierliche Validierung des Prozesses zu gewährleisten. Bei Bedarf wird eine Revalidierung durchgeführt, um die Genauigkeit und Wirksamkeit des Validierungsprozesses zu erhalten.
Die folgende Abbildung 1 zeigt eine schrittweise Darstellung des Validierungsprozesses.
Abbildung 1: Die Etappen des Validierungsprozesses
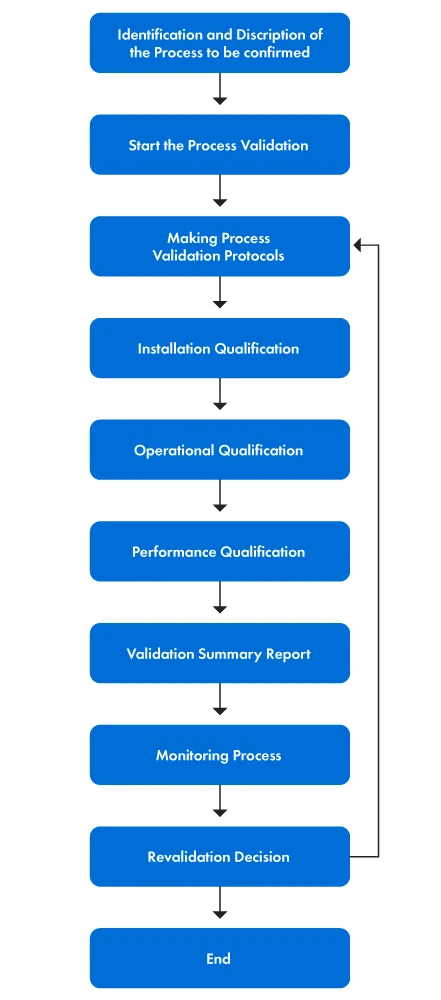
PVP
Aufgrund des breiten Spektrums an Produktionsvolumina und der Komplexität der Herstellung gibt es zahlreiche Ansätze zur Durchführung von Prozessvalidierungen. Die Vorschriften der United States Food and Drug AdministrationUSFDA) und die ISO 13485 bieten jedoch nur begrenzte Vorschläge für spezifische Methoden. Eine weithin anerkannte und maßgebliche Quelle für die Prozessvalidierung von Medizinprodukten ist jedoch ein Leitfaden der Global Harmonization Task Force (GHTF), jetzt International Medical Device Regulators Forum (IMDRF) genannt, der im Jahr 2004 veröffentlicht wurde. Es bleibt die wichtigste Referenz, auch auf der offiziellen Website der USFDA.
Gemäß dem Leitfaden wird ein Validierungsteam gebildet, das einen detaillierten Prozessvalidierungsplan (PVP) erstellt. Prozessvalidierungsprotokolle enthalten ein detailliertes Schema für die Durchführung von IQ, OQ, PQ und Revalidierung. Der PVP sollte die folgenden Elemente enthalten:
- Definition des Geräts und Festlegung des Validierungsansatzes.
- Identifizierung der Elemente, die validiert werden müssen.
- Durchführung von Aktivitäten am vorgesehenen Standort.
- Umriss des Umfangs der Dokumentation.
- Erstellung eines Zeitplans für die Validierungsaktivitäten.
- Erarbeitung eines Gesamtterminplans.
- Führung einer umfassenden Liste und Verweise auf durchgeführte interne und externe Validierungen.
Das Validierungsprotokoll wird vor der Durchführung von Validierungsaktivitäten erstellt. Es sollte vom Validierungsteam erstellt und von der betreffenden Abteilung genehmigt werden. Der Zweck eines Validierungsprotokolls besteht darin, die Testskripte festzulegen, die befolgt werden müssen, um zu gewährleisten, dass die Prozesse und Geräte für die Herstellung sicherer und wirksamer Medizinprodukte bereit sind.
Zum Validierungsprotokoll gehört ein Analysebericht, der Informationen sowie die erforderlichen Analysen, Erläuterungen und Empfehlungen enthält. Diese Aufzeichnungen werden weiter überprüft, um sicherzustellen, dass die folgenden zwei (02) Kriterien erfüllt sind:
- Einhaltung der Regulierungsstandards.
- Alle erstellten Aufzeichnungen und Daten werden auf Ergebnisse, Angemessenheit und Vollständigkeit überprüft.
In der folgenden Abbildung 2 sind der Sortenschutz und die verschiedenen daran beteiligten Prozesse dargestellt.
Abbildung 2: Der PVP und seine Anforderungen
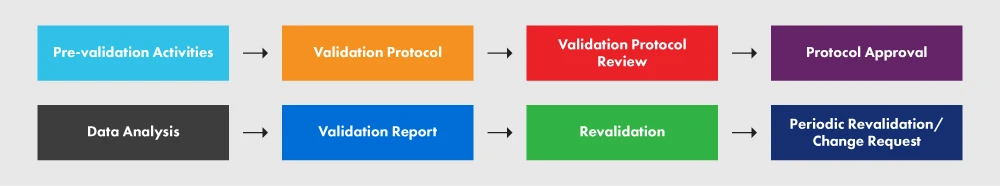
Ein ordnungsgemäß erstelltes Protokoll enthält klare Leitlinien, Richtlinien und Verfahren, die während der Prozessvalidierung einzuhalten sind. Es umfasst Aspekte wie Anlagen, Ausrüstung, Methoden und Schulung. Das Protokoll legt die Prozessinputs und -grenzwerte sowie die wesentlichen Schritte für die erfolgreiche Durchführung des Prozessvalidierungsprojekts fest. Die folgende Übersicht umfasst zwar nicht jedes einzelne Element, das in Ihrem Protokoll erforderlich ist, gibt Ihnen aber einen Überblick über den erforderlichen Detaillierungsgrad. Für ein besseres Verständnis des Prozesses empfehlen wir Ihnen dringend, den Leitfaden zu befolgen.
- Titelseite
- Zu erfassende Produkte
- Zu validierende Geräte/Prozesse
- Allgemein
- Zielsetzungen
- Referenzdokumente
- Validierungsplan
- IQ
- OQ
- PQ
- Mess-/Prüfgeräte und Kalibrierung
- Wartung der Ausrüstung
- Revalidierung
- Validierungsteam Genehmigung/Unterschrift Seite
Das Betriebsmanagement spielt eine entscheidende Rolle bei der Aufrechterhaltung einer optimalen Leistung, indem es die wichtigsten Maßnahmen überwacht, die Arbeitsmethoden und -verfahren überprüft und bei auftretenden Problemen unverzüglich Maßnahmen ergreift. In Fällen, in denen es Probleme gibt, müssen Sie möglicherweise einen Prozess teilweise oder sogar vollständig revalidieren. Gemäß Abschnitt 820.75(c) der USFDA Quality System Regulation (QSR) sollte eine Prozessrevalidierung unter diesen Umständen in Betracht gezogen werden: "Wenn Änderungen oder Prozessabweichungen auftreten, muss der Hersteller diese überprüfen, bewerten und gegebenenfalls eine Revalidierung durchführen. Diese Aktivitäten müssen dokumentiert werden."
Mögliche Auslöser für eine Prozessrevalidierung sind Änderungen an Spezifikationen, Methoden, Verfahren, Software, Entwürfen, Schlüsselkomponenten, Chargenskalierung, Standortwechsel, Ausrüstungsänderungen und dergleichen. Darüber hinaus kann auch die Durchführung von Korrektur- und Vorbeugungsmaßnahmen (CAPA) als Auslöser für eine Prozessrevalidierung dienen. Die Hauptgründe für eine Revalidierung sind folgende:
- Änderungen am Prozess.
- Negativer Qualitätstrend, plötzliche Qualitätsverschlechterung oder eine Häufung von Kundenbeschwerden.
- Umfangreiche Erweiterung der Leitungskapazität.
- Änderungen im Design.
- Änderungen der Produktverpackung.
- Verlagerung eines Prozesses in eine andere Einrichtung.
- Änderungen im Bewerbungsverfahren.
Wenn Sie mehr über Validierungsprotokolle und ihre Bedeutung für die Herstellung von Medizinprodukten erfahren möchten, wenden Sie sich an us. Bleiben Sie informiert! Bleiben Sie compliant!









