
Regulatory Affairs (RA) spielen eine zentrale Rolle bei der Gewährleistung der Sicherheit, Wirksamkeit und Qualität von Arzneimitteln in der dynamischen Pharmabranche. Chemistry, Manufacturing and Controls (CMC) RA für die Einhaltung der Vorschriften unerlässlich. Es zielt darauf ab, die Gesundheit der Patienten zu schützen und das Vertrauen der Öffentlichkeit in pharmazeutische Produkte zu fördern, indem es die Konsistenz und Qualität während des gesamten Arzneimittelherstellungsprozesses sicherstellt.
CMC RA Dokumentations- und Compliance-Anforderungen in Bezug auf die Herstellung, Qualitätskontrolle und Stabilität von pharmazeutischen Produkten. Dabei kommt es auf Detailgenauigkeit und die Einhaltung der behördlichen Richtlinien während des gesamten Lebenszyklus der Arzneimittelentwicklung an. Wenn Sie mehr über die Bedeutung von CMC RA erfahren möchten,wenden Sie sich an unsere Experten.
In diesem Blog werden wir uns mit den Grundlagen von CMC RA befassenRA seine Bedeutung für die Einhaltung von Vorschriften und die Aufrechterhaltung hoher Qualitätsstandards untersuchen.
Die Rolle von CMC der Arzneimittelentwicklung
CMC beginnen früh im Arzneimittelentwicklungsprozess und setzen sich über alle Phasen hinweg fort, von der präklinischen Forschung bis zur Vermarktung. CMC und -Dokumentationen sind wichtige Bestandteile von Zulassungsanträgen, wie z. B. Anträgen für neue Prüfpräparate (Investigational New Drug,IND), Anträgen für neue Arzneimittel (New Drug Applications, NDA) und Anträgen für die Marktzulassung (Marketing Authorization Applications, MAA). Die Zulassungsbehörden prüfen CMC , um die Sicherheit, Identität, Wirksamkeit und Qualität eines Arzneimittels sowie die Zuverlässigkeit und Konsistenz des Herstellungsprozesses zu bewerten.
Sicherstellung der Einhaltung der CMC RA
Die Einhaltung der CMC -Vorschriften ist für einen erfolgreichen Markteintritt von entscheidender Bedeutung. Regulierungsbehörden wie die US-amerikanische Food and Drug Administration (USFDA), die Europäische Arzneimittelagentur (EMA) und andere regionale Gesundheitsbehörden (HAs) sind für die Festlegung von Richtlinien und Standards verantwortlich, die eingehalten werden müssen. Diese Richtlinien decken verschiedene Aspekte ab, darunter Herstellungspraktiken, Qualitätssysteme, Analysemethoden, Stabilitätsprüfungen und Validierung. Die Einhaltung dieser Vorschriften erfordert eine sorgfältige Dokumentation, die Einhaltung der Guten Herstellungspraxis (GMP) und die Implementierung wirksamer Qualitätsmanagementsysteme (QMS).
Die Rolle der CMC für den Erfolg eines Pharmaunternehmens
Die Einhaltung hoher Standards bei CMC bietet Pharmaunternehmen mehrere Vorteile. Zu den wichtigsten Vorteilen zählen:
- Minderung der regulatorischen Risiken.
- Unterstützung erfolgreicher behördlicher Genehmigungen.
- Verringerung der Wahrscheinlichkeit von Produktrückrufen.
- Förderung eines positiven Rufs für Qualität und Zuverlässigkeit.
Überlegungen fürCMC erfolgreicheCMC :
- Auf dem Laufenden bleiben mit regulatorischem Wissen: Die sich ständig weiterentwickelnden regulatorischen Anforderungen der Gesundheitsbehörden erfordern es, stets über die neuesten Richtlinien informiert zu sein. Die kontinuierliche Überwachung regulatorischer Aktualisierungen und deren Einbeziehung in CMC ist für die Aufrechterhaltung der Compliance von entscheidender Bedeutung.
- Einführung von Qualitätssystemen: Dazu gehören die Entwicklung und Pflege umfassender Standard Operating Procedures (SOPs), Verfahren zur Dokumentenkontrolle, Änderungskontrollprozesse und Schulungsprogramme, um sicherzustellen, dass die Mitarbeiter die festgelegten Protokolle verstehen und befolgen.
- Risikobewertung und -minderung: Die Unternehmen sollten potenzielle Risiken während des gesamten Entwicklungs- und Herstellungsprozesses von Arzneimitteln ermitteln und geeignete Strategien zur Risikominderung anwenden. Dazu gehört die Bewertung kritischer Prozessparameter, der Variabilität von Rohstoffen, möglicher Verunreinigungen und der Risiken in der Lieferkette, um die Einhaltung der Vorschriften zu gewährleisten.
- Dokumentation und Datenintegrität: Eine genaue und vollständige Dokumentation ist für den Nachweis der Einhaltung der Vorschriften unerlässlich. Unternehmen müssen eine solide Dokumentationspraxis einführen, einschließlich der Führung von Chargenprotokollen, analytischen Daten, Stabilitätsstudien und Validierungsberichten. Die Gewährleistung der Integrität, Rückverfolgbarkeit und Sicherheit von Daten ist entscheidend, um Probleme bei der Einhaltung der Vorschriften zu vermeiden.
- Wirksames Änderungsmanagement: Unternehmen müssen über klar definierte Änderungskontrollverfahren verfügen, um Änderungen zu bewerten und zu dokumentieren, ihre Auswirkungen auf die Produktqualität und die Einhaltung gesetzlicher Vorschriften zu beurteilen und vor der Umsetzung von Änderungen die erforderlichen Genehmigungen einzuholen.
- Starke Lieferantenpartnerschaften und -management:Dazu gehören die Auswahl qualifizierter Lieferanten, die Durchführung von Audits und der Abschluss von Qualitätsvereinbarungen, in denen Verantwortlichkeiten und Erwartungen festgelegt sind. Die regelmäßige Bewertung der Einhaltung der aktuellen GMP-Anforderungen (cGMP) durch die Lieferanten ist von entscheidender Bedeutung.
- Bereitschaft für Audits und Inspektionen: Unternehmen sollten Selbstbeurteilungen durchführen, um Verbesserungsmöglichkeiten zu ermitteln und sicherzustellen, dass sie für Audits der Aufsichtsbehörden bereit sind. Der Schlüssel zur Einhaltung der Vorschriften liegt in der unverzüglichen Behebung von Prüfungsfeststellungen und der Umsetzung von Korrekturmaßnahmen.
- Kontinuierliche Verbesserung: Dies kann erreicht werden, indem man das Engagement der Mitarbeiter fördert, Schulungen und Weiterbildungen zu den gesetzlichen Anforderungen anbietet und eine qualitätsorientierte Einstellung auf allen Ebenen der Organisation fördert.
- Korrektur- und Vorbeugungsmaßnahmen (CAPA) ansprechen: Durch die systematische Behandlung von Verstößen mit Hilfe der CAPA-Methode können Pharmaunternehmen ihr Engagement für eine kontinuierliche Verbesserung und Einhaltung der Vorschriften unter Beweis stellen.
- Kenntnisse über Änderungen der Rechtsvorschriften nach der Zulassung: Um die Einhaltung der Vorschriften zu gewährleisten, ist es wichtig, die rechtlichen Anforderungen für Änderungen nach der Zulassung zu kennen. Die Implementierung geeigneter Änderungsmanagementprozesse und eine effektive Kommunikation mit den Behörden können helfen, diese Änderungen zu bewältigen und gleichzeitig die Einhaltung der Vorschriften zu gewährleisten.
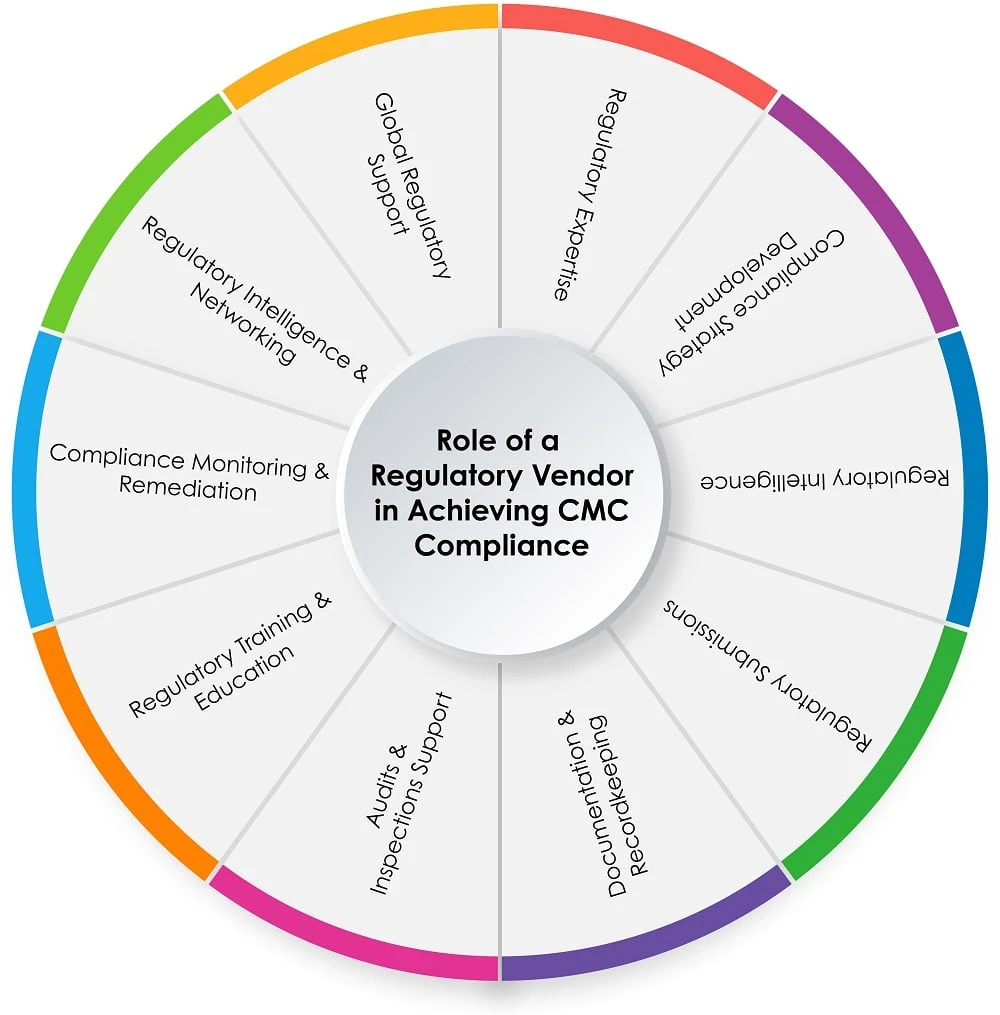
Die Rolle eines Zulassungsdienstleisters im CMC -Prozess
Das untenstehende Kreisdiagramm (Abbildung 1) zeigt die Rolle eines Regulatory-Anbieters im CMC -Prozess:
Abbildung 1: Rolle eines Regulierungsanbieters bei der Erreichung CMC
Schlussfolgerung
Die Einhaltung und Aufrechterhaltung CMC erfordert einen strategischen Ansatz, der funktionsübergreifende Zusammenarbeit, starke Qualitätssysteme und kontinuierliche Regulatory Intelligence (RI) umfasst. Dies ist auch für einen erfolgreichen Marktzugang und die kontinuierliche Produktverfügbarkeit von entscheidender Bedeutung. Ein umfassendes Verständnis der Grundlagen derRA die Umsetzung wirksamer Compliance-Strategien können Pharmaunternehmen dabei helfen, sich im regulatorischen Umfeld zurechtzufinden, Zulassungen zu erhalten und die höchsten Standards in Bezug auf Qualität und Patientensicherheit aufrechtzuerhalten. StrategischePartnerschaften im Bereich der Regulierungkönnen diese entscheidenden Schritte durch die Bereitstellung erstklassiger Fachkenntnisse zur Einhaltung der Vorschriften synergetisch unterstützen.Kontaktieren us, um mehr über unsere Dienstleistungen zu erfahren!









