
Am 9. Februar 2022 begann die Europäische Arzneimittelagentur (EMA) mit der Einrichtung eines Koordinierungszentrums für Datenanalyse und Real-World-Integration (DARWIN EU®). Dies ist der erste Schritt zur Integration von Real-World-Evidence (RWE) in die Bewertung von Arzneimitteln in der gesamten Europäischen Union (EU). Die Gewährleistung der Sicherheit und Wirksamkeit von Arzneimitteln ist die Hauptaufgabe jeder Regulierungsbehörde, und RWE erweist sich als zuverlässige Quelle für die Sammlung von Echtzeitdaten aus globalen Gesundheitsdatenbanken. Daher EMA diese Maßnahme der EMA die Qualität von Arzneimitteln in der EU verbessern und deren Verfügbarkeit beschleunigen.
Wichtige geplante Aktivitäten für das Koordinierungszentrum für DARWIN EU®
Wie wird DARWIN EU® die EMA die zuständigen Behörden im Regulierungsbereich unterstützen?
Innovative Medikamente, die für Patienten leicht verfügbar sind, sind das Gebot der Stunde. Die behördlichen Verfahren für die Entwicklung, Zulassung, Vermarktung und Überwachung nach der Markteinführung nehmen viel Zeit in Anspruch, sodass die Nachfrage nach neuen Medikamenten nicht gedeckt werden kann. Die Verkürzung der Markteinführungszeit bei gleichzeitiger Gewährleistung der Sicherheit, Wirksamkeit und Qualität innovativer Medikamente ist der Weg in die Zukunft. Mehrere globale Gesundheitsbehörden erkennen die Vorteile der Integration von RWE in ihre Zulassungsverfahren, und DARWIN EU® ist die Initiative EMA.
EMA , das Europäische Arzneimittelregulierungsnetzwerk mit dem Europäischen Gesundheitsdatenraum (EHDS) zu verbinden, um den Datenaustausch zu verbessern und den Zugang zu verschiedenen Arten von Gesundheitsdaten im Rahmen dieses Programms zu erleichtern. Außerdem werden Standards für wissenschaftliche Bewertungen und regulatorische Entscheidungen festgelegt.
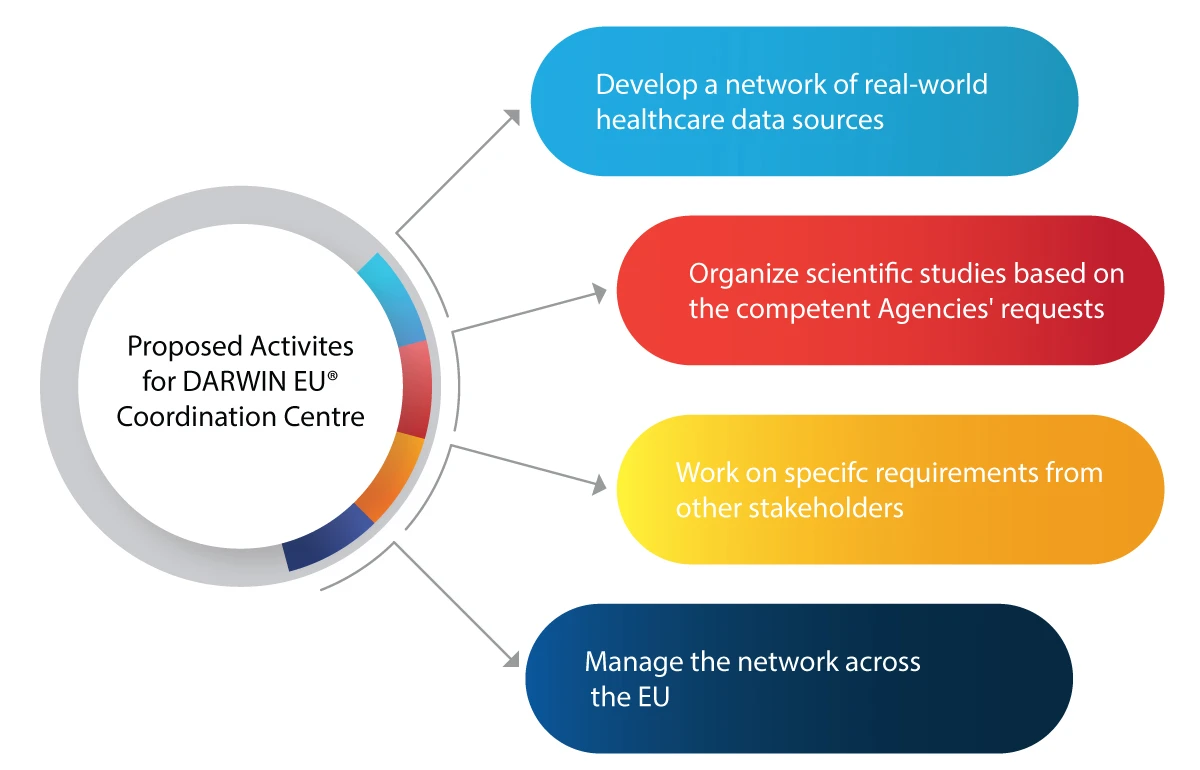
Hier sind einige Aktivitäten, die DARWIN EU® erreichen möchte:
- Einsatz von RWE bei der Entscheidungsfindung für die Zulassung neuer Medikamente, Impfstoffe usw.
- Integration von RWE in den gesamten Lebenszyklus eines Arzneimittels, einschließlich Entwicklung, Zulassung und Überwachung nach dem Inverkehrbringen
- Vorbereitung auf künftige medizinische Notfälle wie Pandemien
- Nutzen für die pharmazeutische Industrie durch aufschlussreiche und zuverlässige Informationen über Patienten, Krankheiten und die Verwendung von Medikamenten
- Fundierte regulatorische Entscheidungen auf der Grundlage von RWE für den sicheren und wirksamen Einsatz von Arzneimitteln treffen
- Verbesserter Zugang zu lebensrettenden Medikamenten für bedürftige Patienten dank genauer und rechtzeitiger Datenanalyse
Vorgeschlagener Zeitplan für DARWIN EU® als voll funktionsfähiges Netzwerk in der EU
Die EMA legt EMA die Zeitpläne für die vollständige Inbetriebnahme von DARWIN EU® fest, die wie folgt aussehen:
- 2021 - Beginn des Projekts
- 2022 – Gründung von DARWIN EU®
- 2023 – Entwicklung von DARWIN EU® und Festlegung seiner Verwendungszwecke
- 2024 – DARWIN EU® vollständig betriebsbereit machen
- 2025 - Verbesserung der regulatorischen Nutzung von Gesundheitsdaten durch Ausweitung des Anwendungsbereichs in Bezug auf Arzneimittel, Geografie usw.
Die EMA mit dem Erasmus University Medical Center Rotterdam bei der Einrichtung von DARWIN EU® EMA . Ziel dieser Partnerschaft ist die Einrichtung eines Koordinierungszentrums zur Schaffung eines verteilten Datennetzwerks. Beide haben auch die Aufgaben übernommen, wissenschaftliche Studien durchzuführen, regulatorische Entscheidungsprozesse zu unterstützen und einen Katalog mit Datenquellen aus der Praxis zu verwalten.
Was bedeutet die Einführung von DARWIN EU® für die Zukunft?
Die EMA die Leiter der Arzneimittelbehörden (HMA) haben stets zusammengearbeitet, um die Herausforderungen zu identifizieren, zeitgebundene Ziele festzulegen und Prioritäten in ihren Fünfjahresstrategiedokumenten zu definieren. Damit soll eine strategische Ausrichtung für die Aktivitäten des Europäischen Netzwerks für Arzneimittelregulierung vorgegeben werden.
Die Einführung von DARWIN EU® ist ein wichtiger Schritt zur Umsetzung der Netzwerkstrategie EMA. Die Durchführung wissenschaftlicher Studien zur Beantwortung von Forschungsfragen, die Unterstützung der Bewertung von Arzneimitteln in der EU und die Pflege metadata Arzneimittelregulierungsaktivitäten sind die Hauptziele. DARWIN EU® soll eine wichtige Rolle bei der Arzneimittelregulierung in Europa spielen, und die Pilotstudien sollen bis Ende 2022 fertiggestellt sein.
Wenn Sie ein Arzneimittelhersteller sind und mehr über RWE und dessen Einfluss auf die Zukunft der regulatorischen Entscheidungsfindung erfahren möchten, wenden Sie sich an die Experten für Regulatory Affairs bei Freyr.









