
Die australische Therapeutic Goods Administration (TGA) hat strenge Vorschriften für die Zulassung neuer verschreibungspflichtiger Arzneimittel mit neuartigen Wirkstoffen. Vor kurzem hat die TGA ein überarbeitetes Verfahren eingeführt, um die Wirksamkeit lebensrettender verschreibungspflichtiger Arzneimittel zu verbessern und sie den Patienten schneller zur Verfügung zu stellen. Diese Änderungen betreffen Anträge, die durch nichtklinische, klinische und/oder Bioäquivalenzdaten gestützt werden müssen (Kategorie 1 und Kategorie 2). Die TGA hat im August ein Dokument mit Einzelheiten zu den entsprechenden gesetzlichen Anforderungen veröffentlicht.
Wesentliche Merkmale des neuen Registrierungsverfahrens für verschreibungspflichtige Arzneimittel
- Die TGA hat ein phasenweises Registrierungsverfahren ausgearbeitet und die einzelnen Phasen als Meilensteine bezeichnet. Jede von ihnen folgt einem eigenen Weg.
- Das neue Verfahren zielt darauf ab, die Qualität der Dossiers zu verbessern. Die Dossiers werden auf der Grundlage eines gemeinsamen Formats für technische Dokumente (CTD) erstellt und entsprechen allen rechtlichen Anforderungen.
- Die Planungsphase vor der Einreichung des Antrags ist wichtig, da die Antragsteller die Einzelheiten des geplanten Antrags einreichen. Dies geschieht mindestens zweieinviertel (02 ¼) Monate vor der Einreichung des vollständigen Dossiers. Diese Phase soll der TGA helfen, die Termine für die nachfolgenden Meilensteine festzulegen und die Ressourcen für die Verwaltung des CTD bereitzustellen.
- Die nächste Phase ist die Einreichung. Sobald dies geschehen ist, erlaubt die TGA dem Antragsteller nicht, nach dem Einreichungsdatum zusätzliche Daten oder Informationen vorzulegen. Es ist zwingend erforderlich, ein vollständiges Dossier einzureichen, das korrekt und von hoher Qualität ist.
- Gemäß Abschnitt 31 des Therapeutic Goods Act 1989 fordert die TGA in der Bewertungsphase zusätzliche Informationen an. Nach der ersten Bewertung werden alle Anfragen gesammelt und dem Antragsteller zugesandt.
Die Meilensteine des Erneuerungsprozesses sind in den folgenden Flussdiagrammen dargestellt.
Meilenstein 1
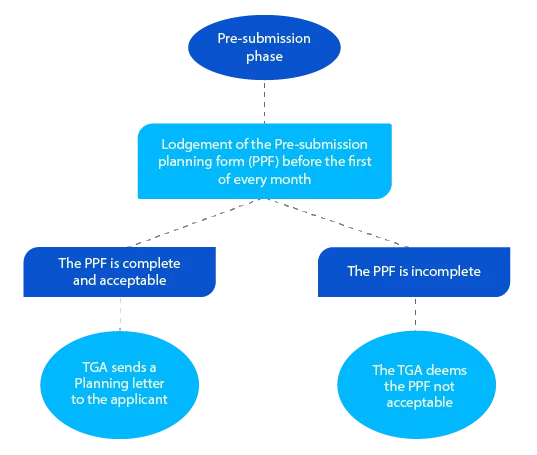
Das Planungsschreiben enthält das voraussichtliche Datum, an dem die TGA die Einreichung des Dossiers erwartet, sowie weitere angestrebte Meilensteindaten für den Antrag auf ein verschreibungspflichtiges Arzneimittel.
Meilenstein 2
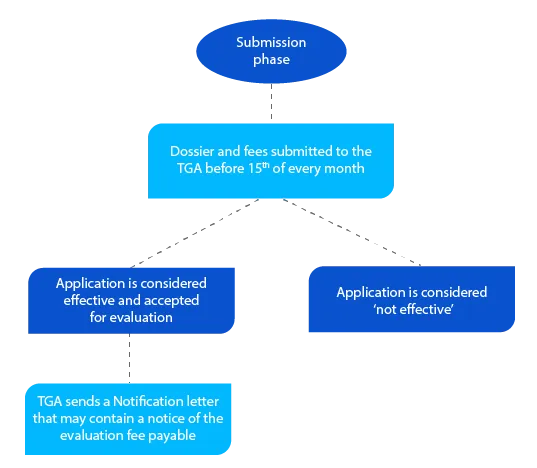
Das Dossier enthält Informationen, die der TGA helfen, den Antrag zu bewerten, und wenn alles akzeptabel ist, wird vor Ende des Monats, in dem der Antragsteller das Dossier eingereicht hat, ein Benachrichtigungsschreiben verschickt.
Meilenstein 3
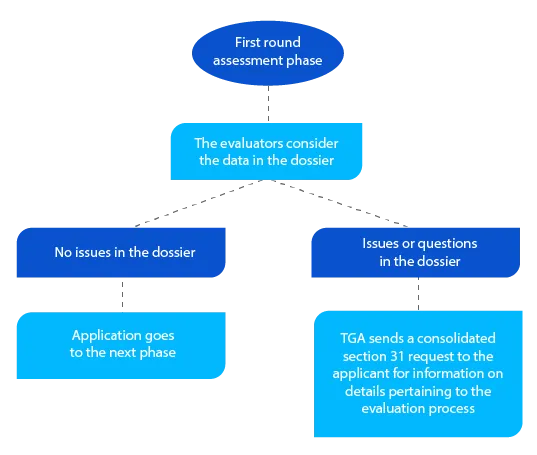
Zusätzlich zu dem konsolidierten Antrag nach Abschnitt 31 übermittelt die TGA gegebenenfalls Kopien der Bewertungsberichte, die von den Gutachtern für Qualität, nichtklinische und klinische Aspekte sowie für Risikomanagementpläne (RMP) erstellt wurden.
Meilenstein 4

Der Antragsteller kann die Antwortzeit nach Abschnitt 31 angeben. Sie kann entweder dreißig (30) oder sechzig (60) Tage betragen und sollte in der PPF hervorgehoben werden. Diese Frist muss von der TGA in dem Planungsschreiben bestätigt werden. Das akzeptable Format für die Antwort ist CTD, und die Antwort muss in Form von gedruckten und elektronischen Kopien übermittelt werden.
Da dies die letzte Chance für den Antragsteller ist, der TGA fehlende Informationen zukommen zu lassen, muss dies in vorschriftsmäßiger Weise geschehen.
Meilenstein 5
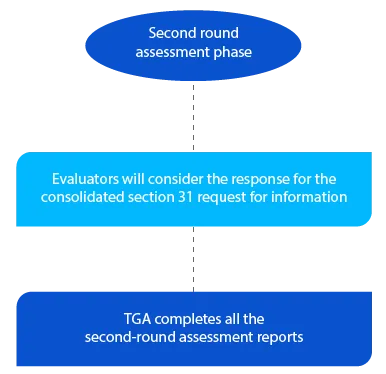
Die TGA verfügt über eine Frist von zwei (02) Monaten für die zweite Runde der Beurteilungsberichte bei Anträgen für neue Generika und von einem (01) Monat für alle anderen Antragsarten. Die Berichte werden den jeweiligen Antragstellern nach Abschluss der zweiten Bewertungsrunde zugesandt.
Meilenstein 6
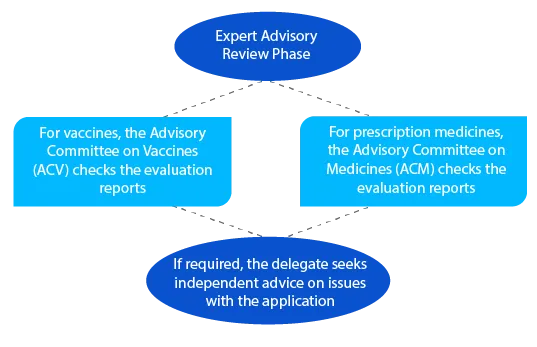
Im Anschluss an die beratende Prüfung versendet die TGA eine Mitteilung mit Einzelheiten zu den Empfehlungen, die sie vom ACV oder der ACM erhält.
Meilenstein 7
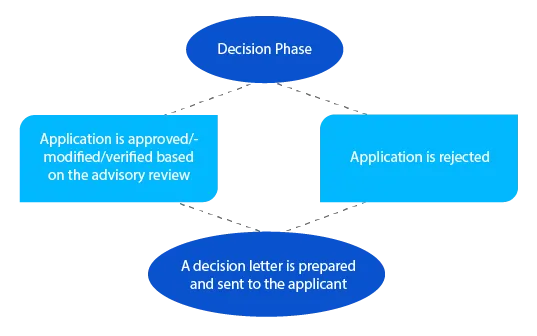
Bei offenen Fragen kann sich der Delegierte in dieser Phase mit dem Antragsteller in Verbindung setzen, bevor er eine Entscheidung trifft. Bei Anträgen gemäß Abschnitt 23 des Therapeutic Goods Act von 1989 (neu bewertete gelistete Arzneimittel im Australian Register of Therapeutic Goods (ARTG)) wird dem Antragsteller innerhalb von achtundzwanzig (28) Tagen nach der Entscheidung eine Mitteilung zugestellt.
Meilenstein 8
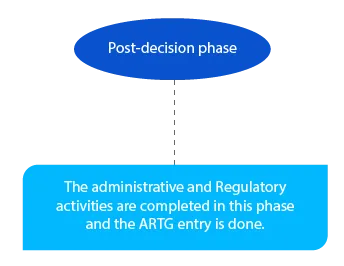
Die ausstehenden Zahlungen werden in dieser Phase erledigt. Und sie müssen bis zum Ende des Monats nach der Entscheidung des Delegierten abgeschlossen sein.
Da die TGA alle Vorkehrungen trifft, um die Sicherheit, Wirksamkeit und Qualität der verschreibungspflichtigen Arzneimittel zu gewährleisten und gleichzeitig deren Markteinführungszeit zu verkürzen, liegt es in der Verantwortung des Antragstellers, die relevanten Unterlagen für einen reibungslosen Registrierungsprozess einzureichen. Unabhängig davon, in welcher Phase Sie sich befinden, ist die Zusammenarbeit mit einem end-to-end , der Experte für die Registrierung verschreibungspflichtiger Arzneimittel ist, die ideale Lösung. Wenden Sie sich an eine erfahrene Regulierungsbehörde, um einen konformen Weg zu finden, auf dem neuesten Stand zu bleiben und die Vorschriften einzuhalten.









