
Der ungedeckte medizinische Bedarf (Unmet Medical Need, UMN) ist eine der dringendsten Prioritäten der Gesundheitssysteme. Die sich ständig weiterentwickelnde Wissenschaft und Technologie im Gesundheitswesen birgt das Potenzial, verschiedene therapeutische Optionen zu erforschen. Die Gesundheitsbehörden fördern innovative Therapien, die einen erheblichen Gewinn für die Lebensqualität der Patienten versprechen. Aufbauend auf der Priorisierung von Innovation und der Ausrichtung auf ungedeckte Patientenbedürfnisse bei der Arzneimittelentwicklung hat die Europäische Arzneimittelagentur (EMA) 2016 den PRIority MEdicines (PRIME)-Pfad eingeführt. Seitdem ist der PRIME-Pfad eine Methode zur beschleunigten Zulassung innovativer Therapien. Diese Art des vereinfachten Zulassungsverfahrens kann von jedem Unternehmen in Anspruch genommen werden, von Start-ups über mittelständische Biotech-Unternehmen bis hin zu großen multinationalen Konzernen. Die Qualifizierung für das Verfahren ist jedoch auf Produkte beschränkt, die sich in der Entwicklung befinden und für die noch keine Zulassung im Rahmen des zentralisierten Verfahrens beantragt wurde. Die Qualifizierungskriterien werden streng angewendet. Zwischen März 2016 und April 2022 wurden nur 24 % der Anträge bewilligt, während 72 % der PRIME-Anträge abgelehnt wurden. Von den 24 %, die für das PRIME-Verfahren ausgewählt wurden, gehörte die Mehrheit zum therapeutischen Bereich der Onkologie.
Innovatoren, die eine Marktzulassung für seltene Krankheiten oder Orphan-Arzneimittel anstreben, verfügen häufig nur über begrenzte Datensätze, um ihre Anträge für neuartige Arzneimittel gemäß den Anforderungen der Aufsichtsbehörden zu untermauern. Anträge für Arzneimittel für neuartige Therapien (ATMPs) und Orphan-Arzneimittel stehen in der Regel vor solchen Herausforderungen. Aufgrund der begrenzten Daten zur Patientenpopulation wird eine ständige Interaktion mit den Regulierungsbehörden empfohlen, um bessere Einblicke für die wissenschaftliche Überprüfung und die Zulassungsanforderungen zu ermöglichen. Der PRIME-Pfad kann für solche Therapien nützlich sein, da die Regulierungsbehörden frühzeitig einbezogen werden, um proaktive Unterstützung und Anleitung für die Datenerhebung und die Nutzen-Risiko-Bewertung zu bieten.
Vorteile des PRIME-Wegs
- Hilft Innovatoren bei der Ausarbeitung eines gut durchdachten Entwicklungsplans.
- Nutzen für die Innovatoren durch Einbindung der Gesundheitsbehörden in einem frühen Entwicklungsstadium; dies trägt zur Ausarbeitung qualitativ hochwertiger Zulassungsanträge bei.
- Beschleunigt die Gesamtbewertung durch Verkürzung der durchschnittlichen Bewertungszeit, sodass Medikamente schneller reach können.
- unterstützt die Innovatoren dabei, sich auf die Entwicklung von Medikamenten zu konzentrieren, die die Ergebnisse für die Patienten verbessern und den ungedeckten Bedarf der Patienten decken.
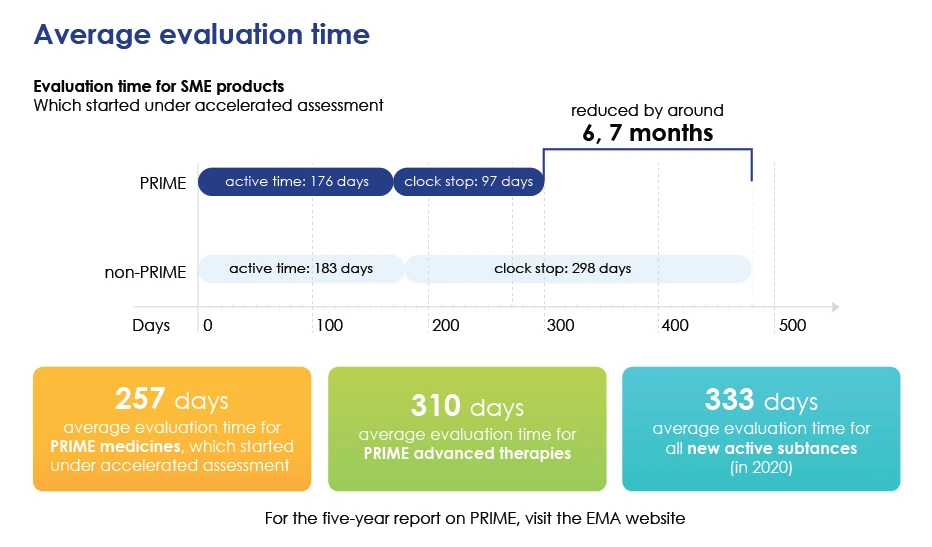
Auswertung Zeit im Detail
Bewerbungen für den PRIME Pathway
Der PRIME-Pfad räumt ungedeckten medizinischen Bedürfnissen Priorität ein. Von den 384 PRIME-Anträgen, die seit März 2016 eingegangen sind, haben es nur 18 bis Juni 2021 bis zur Marktzulassung geschafft.

Sind Sie PRIME-bereit?
Die Existenz des PRIME-Pfads ist auf den erheblichen ungedeckten medizinischen Bedarf und die Konzentration auf die Überbrückung der Lücken durch das European Medicines Regulatory Network (EMRN) zurückzuführen. Um zu beurteilen, ob ein Produkt für den PRIME-Pfad geeignet ist, muss man Folgendes berücksichtigen:
- Feststellungen: Die Antragsteller müssen den ungedeckten medizinischen Bedarf angeben und überzeugend darlegen, wie ihr Produkt das Problem lösen wird.
- Potenzial: Die Antragsteller müssen das Nutzenpotenzial der Therapie anhand der Kriterien für den ungedeckten medizinischen Bedarf nachweisen.
- Präklinische Daten: Die Antragsteller müssen einige Daten über die Wirksamkeit oder Leistung der Therapie im biologischen System des Menschen vorlegen. Nicht-klinische Modelle, auch wenn sie noch so genau sind, geben keinen genauen Überblick über das Verhalten im menschlichen biologischen System.
- Stadium der Entwicklung: Der Antragsteller muss das richtige Stadium für den Eintritt in den PRIME-Pfad ermitteln, um eine optimale Beratung durch die Regulierungsbehörden zu erhalten und mit dem Antrag fortzufahren.
Buchen Sie den PRIME-Zuschuss
Sobald einem Antragsteller die Möglichkeit gewährt wurde, den vereinfachten Weg zu beschreiten, EMA die EMA :
- Benennen Sie einen Berichterstatter aus dem Ausschuss für Humanarzneimittel (CHMP) oder, im Falle von fortgeschrittenen Therapien, aus dem Ausschuss für fortgeschrittene Therapien (CAT).
- Organisation einer Auftaktsitzung mit dem CHMP/CAT-Berichterstatter und einer multidisziplinären Expertengruppe, um Leitlinien für den Gesamtentwicklungsplan und die Regulierungsstrategie zu erarbeiten.
- Bestimmen Sie einen einzigen Ansprechpartner für den Antragsteller.
- Wissenschaftliche Beratung an jedem wichtigen Meilenstein der Entwicklung, unter Einbeziehung einer zusätzlichen Gruppe von Interessenvertretern, wie z. B. Gremien für die Bewertung von Gesundheitstechnologien, um den Zugang der Patienten zu dem neuen Arzneimittel zu beschleunigen.
- Bestätigung des Potenzials für eine beschleunigte Bewertung zum Zeitpunkt der Antragstellung bei der Prüfung der Marktzulassung.
Ist Ihr Antrag für den PRIority MEdicine-Pfad bereit (PRIME-ready)? Kontaktieren Sie Freyr noch heute und lassen Sie sich beraten. Erfahren Sie mehr darüber, wie wir Sie bei Ihrer Zulassungsstrategie und der PRIME-Pfad-Zertifizierung unterstützen können. Bleiben Sie auf dem Laufenden. Bleiben Sie konform.









