
Um den Zugang zu innovativen Medikamenten für Patienten im Vereinigten Königreich nach dem Brexit zu verbessern, wurde im Januar 2021 ein neues, beschleunigtes Zulassungsverfahren namens „Innovative Licensing and Access Pathway” (ILAP) eingeführt. Sein vorrangiges Ziel war es, allen Beteiligten einen integrierten Fahrplan zur Verfügung zu stellen, der den Prozess der Produktentwicklung verbessert. ILAP unterstützt kommerzielle und nichtkommerzielle Entwickler zusätzlich, indem es den Zugang zu innovativen Medikamenten für Patienten erleichtert und die Markteinführungszeit verkürzt. Pharmaunternehmen können ILAP als Weg in Betracht ziehen, sobald die nichtklinischen Daten konsolidiert sind. Das Verfahren ist für neue chemische Wirkstoffe (NCE), biologische Arzneimittel, neue Indikationen und umgewidmete Arzneimittel anwendbar.
Das ILAP ist eine Initiative, die gemeinsam von der Medicines and Healthcare products Regulatory Agency (MHRA) in Zusammenarbeit mit dem All-Wales Therapeutics and Toxicology Centre (AWTTC), dem National Institute of Health and Care Excellence (NICE) und dem Scottish Medicines Consortium (SMC) als ständigen Partnern entwickelt wurde. Zu den unterstützenden Partnern des ILAP gehören der National Health Service England (NHS), die Health Research Authority (HRA) und das National Institute for Health Research (NIHR). Gemeinsam vermitteln die Interessengruppen in der frühen Phase der Arzneimittelentwicklung während klinischer Studien verbesserte regulatorische, wissenschaftliche, ethische und kommerzielle Beiträge.
Nach Ansicht Freyrbietet das ILAP große Chancen für Entwickler innovativer Therapien, insbesondere für diejenigen, die sich mit ungedeckten Patientenbedürfnissen befassen. Gegen eine relativ geringe Gebühr (ca. 8000 £) kann ein Unternehmen sich frühzeitig beraten lassen, eine Zulassung für sein Produkt erhalten und ein Zielprofil für die Entwicklung vereinbaren. Dies kann zu einer erheblichen Zeitersparnis im gesamten Produktentwicklungszyklus führen. Es ist auch von Vorteil, über die Marktzulassung hinauszublicken und frühzeitig Vorbereitungen für Verhandlungen über die Kostenerstattung zu treffen.
Das ILAP schneidet im Vergleich zu ähnlichen Programmen innerhalb des europäischen Arzneimittelnetzwerks (wie beispielsweise PRIME) gut ab. Obwohl es sich in Konzept und Umsetzung unterscheidet, hat das ILAP breitere Zulassungskriterien und eine höhere Zulassungsquote. Das ILAP bietet auch einen Weg zur Integration in das Projekt Orbis der US-amerikanischen Food and Drug Administration (USFDA) für neue Onkologieprodukte.
Wie kann man sich für den ILAP bewerben?
Um Zugang zum ILAP zu erhalten, müssen Antragsteller einen Innovationspass (Innovation Passport, IP) beantragen. Durch die Erlangung einer IP-Bezeichnung erhalten Arzneimittelentwickler Zugang zu diesem Verfahren auf der Grundlage der Nachweise, die erforderlich sind, damit ein Produkt die von NICE, SMC, AWTTC und MHRA festgelegten Zulassungskriterien erfüllt.
Diese Bezeichnung wirkt als Katalysator für innovative Produkte von der präklinischen bis zur mittleren Entwicklungsphase. Das IP kann zur Definition eines TDP-Dokuments (Target Development Profile) führen. Das TDP ist ein Fahrplan, der den Zugang zu den ILAP-Partnern in frühen Stadien der Arzneimittelentwicklung erleichtert, um den Zugang der Patienten zu neuen und innovativen Behandlungen zu beschleunigen und zu beschleunigen. Die Patienten sind Teil dieses gesamten Prozesses. Mehrere vom ILAP bereitgestellte Instrumente unterstützen Antragsteller in allen Phasen des Entwurfs-, Entwicklungs- und Zulassungsprozesses.
Kriterien für die Benennung eines innovativen Passes
Die MHRA legen die Kriterien für eine IP-Bezeichnung fest. Dies ist besonders für innovative Produkte relevant und steht auch im Vergleich zu ähnlichen Programmen in Europa gut da.
Künftig kann sich die spezifische Anwendbarkeit des geistigen Eigentums für Medizinprodukte und Kombinationsprodukte - Bereiche, in denen es immer wieder bedeutende Innovationen gibt - als vorteilhaft erweisen.
Die IP-Bezeichnung wird von den ständigen und unterstützenden Partnern anhand der folgenden Kriterien bewertet:
- Kriterium 1: Einzelheiten zum Zustand, zum Patienten oder zum öffentlichen Gesundheitsbereich
- Bei lebensbedrohlichen und schweren Erkrankungen
- In einem Fall, in dem der Bedarf für die Patienten entscheidend ist
- Kriterium 2: Das Arzneimittel erfüllt einen oder mehrere spezifische Bereiche, darunter
- Innovative Medizin
- Arzneimittel in Verbindung mit einer neuen Indikation
- Medizin für seltene Krankheiten
- In der Entwicklung befindliche Medikamente für das Ziel der öffentlichen Gesundheit im Vereinigten Königreich
- Kriterium 3: Das Arzneimittel hat das Potenzial, Folgendes zu bieten
- Eine kurze Beschreibung, wie das vorgeschlagene Arzneimittel oder die Indikation den Patienten zugute kommt.
- Stellungnahmen von Patienten oder Patientenorganisationen sind erwünscht.
Nach Einreichung des IP-Antrags MHRA ein Treffen zwischen den Antragstellern und der MHRA statt, um zu klären, ob das Produkt die drei (03) Kriterien erfüllt.
Nach den neuesten Informationen vom Januar 2022 MHRA die MHRA einundsiebzig (71) Anträge erhalten, von denen einundvierzig (41) zur IP-Bezeichnung geführt haben, zweiundzwanzig (22) derzeit bearbeitet werden und sieben (07) abgelehnt wurden.
Der richtige Zeitpunkt für den Eintritt in den ILAP wird im Folgenden genannt.
- Im frühen bis mittleren Entwicklungsstadium des Produkts
- Wenn relevante Daten verfügbar sind
- Wenn die Antragsteller das Bedürfnis haben, Beiträge von den Interessengruppen zu erhalten
- Die Antragsteller streben neue innovative Ansätze an
- Nicht, wenn sich das Produkt am Ende der Entwicklungsphase befindet
Überblick über die Entwicklung von Medikamenten
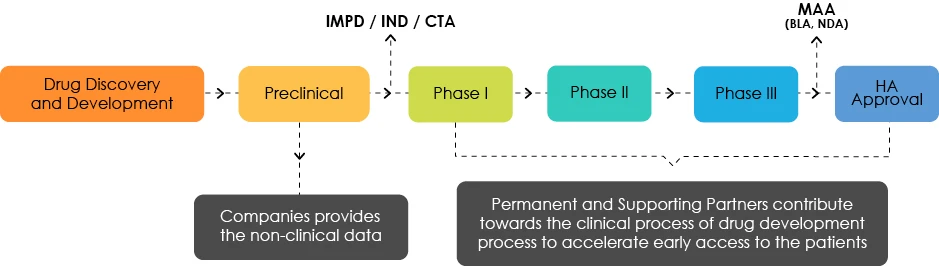
Das Zielentwicklungsprofil (TDP) verstehen
Die TDP-Experten analysieren die Produkteigenschaften und weisen auf Mängel aus Sicht der Regulierungsbehörden hin. Sie sind dafür verantwortlich, den Entwicklern von Arzneimitteln Hinweise auf einen Fahrplan zu geben, der einen frühzeitigen Zugang zu ihren Produkten für Patienten ermöglicht.
Der Produktentwicklungsplan ist ein Dokument, das auf Echtzeitbasis entsprechend den Anforderungen der Produktentwicklung aktualisiert wird. Daher wird der TDP für ein Produkt mehrfach geändert, wenn neue Daten generiert werden.
Der Zugang der Patienten zu lebenswichtigen Medikamenten kann durch Verzögerungen auf dem Markt beeinträchtigt werden. Um solche Szenarien zu vermeiden, dienen beschleunigte Zulassungsverfahren als Katalysator. Das ILAP ist ein Beispiel für ein flexibles Zulassungsverfahren, das in der gesamten Branche gut angenommen wird und die Entwicklungszeit innovativer Medikamente verkürzen kann. Die detaillierten Kriterien, die vom britischen Gesundheitssystem definiert wurden, ermöglichen es Antragstellern, ihre Berechtigung zur Beantragung einer IP-Kennzeichnung zu prüfen. Die Schaffung von Anreizen für ungedeckte klinische und Patientenbedürfnisse durch beschleunigte Verfahren wie das ILAP erleichtert den Markteintritt und kann Risikopatienten entlasten. Um die Interessen der Patienten zu schützen, machen die Gesundheitsbehörden keine Kompromisse hinsichtlich der Sicherheit, Wirksamkeit oder Qualität des Produkts und gewährleisten gleichzeitig einen beschleunigten Zulassungsprozess.Die End-to-End-Regulierungsdienstleistungen von Freyr vereinfachen den Dokumentationsprozess, um die Innovative Passport-Bezeichnung in kurzer Zeit zu unterstützen, sodass Ihre Produkte früher reach . Kontaktieren Sie Freyr.









