
Einem neuen Bericht eines europäischen Generikahandelsverbands zufolge können sich extreme Kostendämpfungsmaßnahmen negativ auf die Generika-Lieferkette auswirken, indem sie zu einer Konsolidierung der Generikaproduktion und zur Rücknahme solcher Produkte vom Markt führen. In einer aktuellen Pressemitteilung von Medicines for Europe heißt es weiter, dass es Beweise dafür gibt, dass extreme Kostendämpfungsmaßnahmen kontraproduktive Auswirkungen auf Generika haben. Auch auf dem Markt der Europäischen Union (EU) besteht deshalb die Gefahr, dass wichtige und weniger teure Arzneimittel vom Markt genommen werden.
Der Bericht vom 23. November 2021 bezieht sich auf den European Commission aus dem Jahr 2018, der einen Patentschutz von bis zu dreizehn (13) Jahren für innovative Arzneimittel vorsieht. Ergänzende Schutzzertifikate für pharmazeutische Wirkstoffe (API) für weitere fünf (05) Jahre verlängern den API-Schutz auf dem EU-Markt auf insgesamt bis zu fünfundzwanzig (25) Jahre. Während dieses Zeitraums bleibt der Preis des Produkts unverändert und es wird vor Konkurrenzprodukten geschützt.
Hersteller, die patentfreie Innovationen bevorzugen, halten diese für eine kostengünstige Alternative. Obwohl die Gesamtkosten für patentfreie Produkte etwa die Hälfte oder mehr der Kosten für die Entwicklung eines neuen Arzneimittels (ein Arzneimittelentwurf, bei dem in einem iterativen Prozess die dreidimensionale Struktur des Rezeptors zur Entwicklung neuartiger Moleküle verwendet wird) betragen, erweisen sie sich als die bessere Option.
Für die meisten Arzneimittelhersteller ist das Repurposing von Arzneimitteln die ideale Option für Innovationen außerhalb des Patentschutzes. Dabei handelt es sich um einen Prozess, bei dem bestehende Arzneimittel auf neue therapeutische Einsatzmöglichkeiten hin untersucht werden. Mehrere Pharmaunternehmen entwickeln mit dieser effizienten, zeitsparenden und kostengünstigen Strategie neue Medikamente.
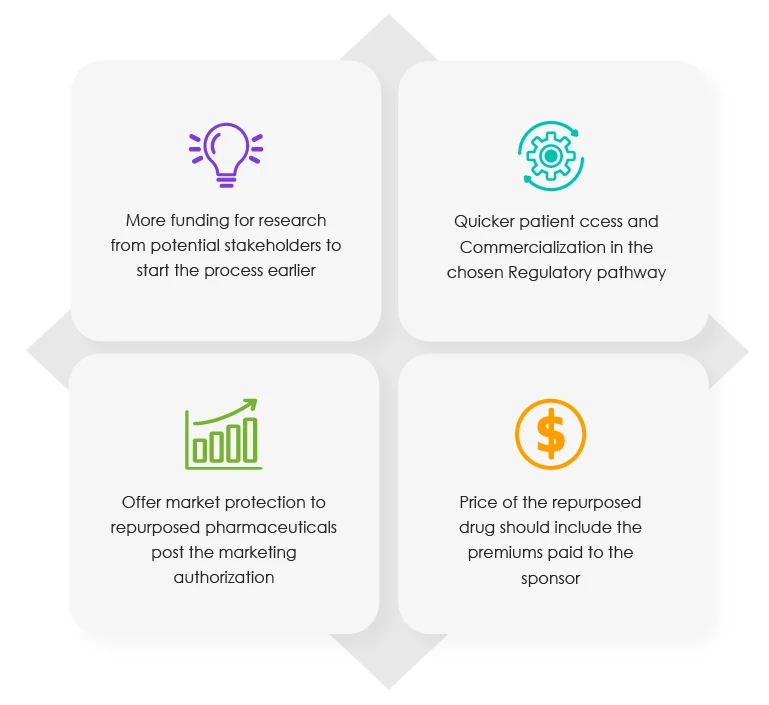
Der Kommissionsbericht von 2018 enthält das Protokoll, das bei der Neupositionierung von Arzneimitteln einzuhalten ist. Er enthält auch die regulatorischen Anreize, die den Inhabern von Zulassungen für bestimmte Arzneimittel zur Verfügung stehen . Laut dem jüngsten Bericht des oben genannten Branchenverbands sollten die folgenden vier (04) Vorteile in verschiedenen Phasen des Repositionierungsprozesses angeboten werden.
Vorgeschlagene Anreize für Sponsoren in verschiedenen Stadien des Neupositionierungsprozesses
Um patentfreie Innovationen auf dem EU-Markt zu fördern, wurde in der jüngsten Vergangenheit viel getan. Dazu gehört der Aufbau eines öffentlich-privaten Rahmens für die Wiederverwendung von Arzneimitteln durch ein Expertenteam. Der vorliegende Bericht stützt sich auf diesen Rahmen, der im Oktober 2021 eingeführt wurde. Er zielt darauf ab, die ungenutzte Innovationsquelle im pharmazeutischen Bereich optimal zu nutzen, um den ungedeckten Bedarf an lebensrettenden Medikamenten zu decken.
Wenn Sie als Generika-Hersteller den Eintritt in den EU-Markt anstreben, Freyr Sie durch zeitnahe Informationen zu den neuesten regulatorischen Änderungen und die Beratung durch einen Partner wie Freyr die besten Compliance-Verfahren anwenden und erhebliche Kosten einsparen. Bleiben Sie informiert. Bleiben Sie konform.









