
Der Bedarf an lebensrettenden Medikamenten steigt stetig. Aufgrund neu auftretender tödlicher Krankheiten investieren Arzneimittelhersteller viel Zeit und Geld in die Forschung und Entwicklung chemischer und biologischer Medikamente. So anspruchsvoll die Entwicklung innovativer Medikamente auch ist, so schwierig kann es für Hersteller sein, diese zu registrieren. Von der Vorbereitung und Einreichung des Antrags auf Zulassung eines neuen Prüfpräparats (Investigational New Drug Application,IND) über Anträge auf klinische Studien (Clinical Trial Applications, CTAs) bis hin zu Zulassungsanträgen (Marketing Authorizations, MAs) gibt es eine Reihe von behördlichen Verfahren, die gemäß den Vorgaben der jeweiligen Gesundheitsbehörden (Health Authorities, HAs) zu befolgen sind.
Die Hersteller müssen es gleich beim ersten Mal richtig machen, damit die innovativen Medikamente ohne Verzögerungen reach Markt reach . Dies trägt dazu bei, die Nachfrage nach lebensrettenden Medikamenten in bestimmten Märkten zu decken und den Return on Investment (ROI) für die Hersteller sicherzustellen.
Der Bedarf an verbesserten Regulierungslösungen und konformen Prozessen ist daher sehr groß. Es gibt mehrere Gründe, aus denen die Hersteller nicht in der Lage sind, den richtigen Weg zu gehen.
Regulatorische Herausforderungen für die Hersteller innovativer Arzneimittel
- Mangelndes Verständnis für die Komplexität der Rechtsvorschriften
- Begrenzte Kenntnisse über die verschiedenen Phasen der bei den HA einzureichenden Anträge
- Fristen für die Einreichung der medizinischen Dossiers, des Gemeinsamen Technischen Dokuments (CTD), der klinischen Studienberichte (CSR) usw.
- Unterschiedliche Vorschriften, wenn die Arzneimittel weltweit verkauft werden sollen
- Mangelnde Vorbereitung auf die Bewältigung von Problemen und Schwierigkeiten, die in der Produktionsphase auftreten
Vorteile der Zusammenarbeit mit dem richtigen Anbieter von Regulierungsdiensten und -lösungen:
Der richtige Partner stellt sicher, dass alle Schritte der Arzneimittelherstellung mit den einschlägigen Zulassungsbehörden übereinstimmen und zu rechtzeitigen Einreichungen führen.
Es gibt vier (04) Stufen der Herstellung von innovativen Arzneimitteln. Diese sind wie folgt:
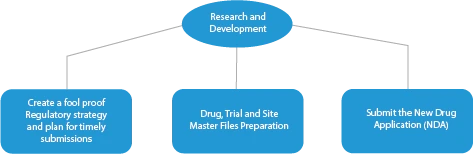
- Forschung und Entwicklung
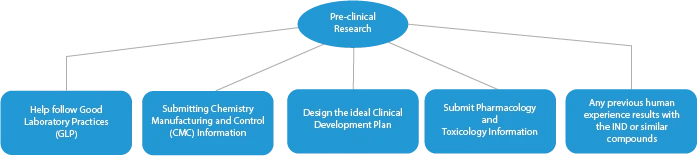
- Vorklinische Forschung/Prüfungen
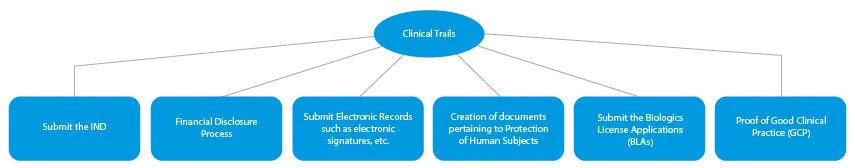
- Klinische Studien
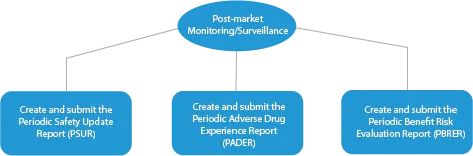
- Überwachung nach dem Inverkehrbringen (Post-market Monitoring/Surveillance)
Jede Phase der Arzneimittelentwicklung erfordert eine Reihe von Dokumenten, die bei den zuständigen Behörden eingereicht werden müssen. Im Folgenden wird dargestellt, wie ein etablierter Anbieter von Zulassungsdiensten in allen Phasen helfen kann.
Schlusswort
Angesichts der steigenden Lebenserwartung der Weltbevölkerung besteht ein Bedarf an neuen Medikamenten. Innovationen im Bereich der Biowissenschaften haben zu mehreren Erfindungen lebensrettender Medikamente geführt. Viele davon befinden sich in verschiedenen Phasen der Herstellung. Unabhängig davon, in welcher Phase sich Ihr Produkt befindet, kann Ihnen die Zusammenarbeit mit einem globalen Dienstleister für regulatorische Angelegenheiten wie Freyr, der über Fachwissen im Bereich der Zulassung innovativer Medikamente verfügt, dabei helfen, Verstöße gegen Vorschriften zu vermeiden und sicherzustellen, dass die neuen Medikamente rechtzeitig reach Markt reach . Bleiben Sie informiert. Bleiben Sie konform.









