
Die pharmazeutische Industrie agiert in einem zunehmend globalisierten Umfeld, in dem die Notwendigkeit harmonisierter regulatorischer Ansätze wichtiger denn je geworden ist. Die globale Harmonisierung der Zulassungsvorschriften zielt darauf ab, die technischen Anforderungen für die Entwicklung und Bewertung von Arzneimitteln in verschiedenen Regionen anzugleichen, Prozesse zu rationalisieren und die Effizienz zu verbessern. Dieser umfassende Überblick untersucht die Komplexität, die Herausforderungen und die Möglichkeiten, die sich aus der globalen Harmonisierung der Rechtsvorschriften im Pharmasektor ergeben.
Die Entwicklung der regulatorischen Harmonisierung
Die Harmonisierung der Rechtsvorschriften hat einen langen Weg hinter sich, denn die Systeme waren früher sehr unterschiedlich. Vor fünfzig Jahren waren die pharmazeutischen Vorschriften weitgehend unabhängig und divergent, und die einzelnen Länder arbeiteten getrennt an der Stärkung ihrer Regulierungskapazitäten. Heute ist eine zunehmende Harmonisierung zu beobachten, die von der Zusammenarbeit bei bestimmten Themen bis hin zu Abkommen über die gegenseitige Anerkennung (MRA) und sogar zur vollständigen Integration in Fällen wie der Europäischen Union reicht.
Arten von Harmonisierungsinitiativen
Die Bemühungen um eine Harmonisierung der Rechtsvorschriften können in drei (3) Haupttypen eingeteilt werden:
- Bilaterale Abkommen bestehen zwischen zwei (2) Ländern oder zwischen einem (1) Land und einer Gruppe von Ländern. Ein Beispiel ist das Abkommen zwischen der EU und Israel über die Konformitätsbewertung und Anerkennung gewerblicher Produkte.
- Regionale Initiativen: Diese umfassen mehrere Länder innerhalb einer bestimmten geografischen Region. Beispiele hierfür sind die Europäische Union (EU), das Panamerikanische Netzwerk für die Harmonisierung von Arzneimittelvorschriften (PANDRH) und die Asiatisch-Pazifische Wirtschaftskooperation (APEC).
- Globale Initiativen: Diese umfassen weltweite Bemühungen, die häufig von internationalen Organisationen geleitet werden. Die Weltgesundheitsorganisation (WHO) und der Internationale Rat für Harmonisierung (ICH) sind wichtige Akteure bei den globalen Harmonisierungsbemühungen.
Schlüsselakteure der globalen regulatorischen Harmonisierung
Mehrere Organisationen spielen eine entscheidende Rolle bei der Förderung der weltweiten Harmonisierung von Rechtsvorschriften:
- International Council for Harmonisation (ICH): ICH harmonisierte Leitlinien für die Entwicklung und Zulassung von Arzneimitteln. Ihre Leitlinien umfassen wissenschaftliche und technische Aspekte der präklinischen und klinischen Forschung, der Herstellung und der elektronischen Datenstandards.
- Weltgesundheitsorganisation (WHO): WHO die Harmonisierung durch verschiedene Initiativen, darunter die Internationale Pharmakopöe, Standards für die Arzneimittelüberwachung und das Vorqualifizierungsprogramm für Arzneimittel.
- Regulierungsbehörden: Behörden wie die US-amerikanische Food and Drug Administration (FDA) und die Europäische Arzneimittelagentur (EMA) beteiligen sich aktiv an Harmonisierungsbemühungen und setzen harmonisierte Leitlinien um.
- Branchenverbände: Organisationen wie die International Federation of Pharmaceutical Manufacturers & Associations (IFPMA) bringen ihr Branchenwissen in die Entwicklung einheitlicher, harmonisierter Normen und Standards ein.
Diese Akteure arbeiten gemeinsam an der Entwicklung von konsensbasierten Leitlinien und Standards, die weltweit umgesetzt werden können und ein harmonisierteres Regulierungsumfeld fördern.
Vorteile und Herausforderungen der regulatorischen Harmonisierung
Die Harmonisierung der Rechtsvorschriften bietet zahlreiche Vorteile für die pharmazeutische Industrie, die Aufsichtsbehörden und die Patienten:
- Weniger Doppelarbeit bei klinischen Studien und Tierversuchen
- Schnellerer Zugang zu neuen Medikamenten für Patienten
- Niedrigere Kosten für die Arzneimittelentwicklung
- Effizientere Verfahren zur Überprüfung von Rechtsvorschriften
- Verbesserte Integrität der globalen Lieferkette
Die Harmonisierungsbemühungen stehen auch vor mehreren Herausforderungen:
- Unterschiede in den nationalen Rechtsrahmen und Regulierungssystemen
- Unterschiedliches Niveau der Regulierungskapazitäten in den einzelnen Ländern
- Kulturelle und sprachliche Barrieren
- Harmonisierung mit nationaler Souveränität und lokalen Gesundheitsprioritäten in Einklang bringen
- Mit dem raschen technologischen Fortschritt in der Arzneimittelentwicklung Schritt halten
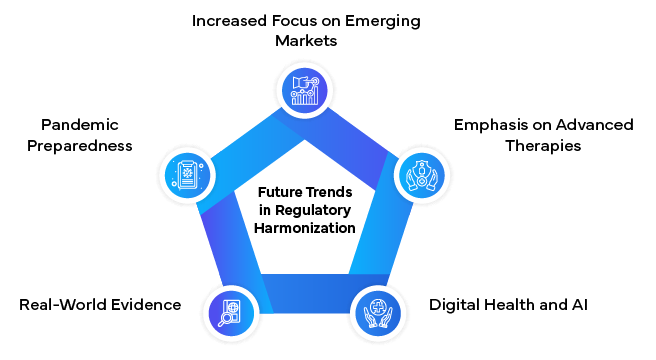
Schlussfolgerung
Um die Komplexität der globalen Harmonisierung der Rechtsvorschriften in der pharmazeutischen Industrie zu bewältigen, ist ein tiefes Verständnis der sich entwickelnden Landschaft, der Hauptakteure und der aktuellen Herausforderungen erforderlich. Obwohl bereits erhebliche Fortschritte erzielt wurden, sind weitere Anstrengungen erforderlich, um ein wirklich harmonisiertes globales regulatorisches Umfeld zu schaffen.
Mit diesen Strategien können pharmazeutische Unternehmen, Zulassungsbehörden und andere Interessengruppen zu einem stärker harmonisierten globalen Regulierungsumfeld beitragen. Dies wiederum wird den Patienten weltweit einen schnelleren Zugang zu sicheren, wirksamen und hochwertigen Arzneimitteln ermöglichen und gleichzeitig Innovation und Effizienz in der Pharmaindustrie fördern.









