
In der stark regulierten Landschaft der Biowissenschaftsbranche ist die Einhaltung der produktspezifischen Richtlinien (PSGs) für die erfolgreiche Entwicklung und Zulassung von Arzneimitteln von größter Bedeutung. PSGs sind umfassende Dokumente, die von den globalen Gesundheitsbehörden herausgegeben werden, um Leitlinien für die Zulassung pharmazeutischer Produkte in bestimmten therapeutischen Kategorien bereitzustellen.
In diesem Blog werden der Zweck, die Relevanz und die Sichtweise der HA bei der Erstellung von PSGs erläutert. Die Gründe und Erwartungen, die in den PSGs formuliert sind und den strategischen Erfolg von Life-Sciences-Unternehmen ermöglichen, werden in diesem Artefakt näher erläutert.
Verständnis der produktspezifischen Richtlinien und ihrer Arten
Die PSG spielen eine zentrale Rolle bei der Gestaltung des Zulassungsweges für pharmazeutische Produkte. Durch die Bereitstellung gezielter Leitlinien sorgen die PSG für eine konsistente und solide Bewertung von Produktanträgen innerhalb bestimmter therapeutischer Kategorien. Indem sie sich an die PSG halten, können Pharmaunternehmen durch die komplizierte Zulassungslandschaft navigieren und sicherstellen, dass ihre Produkte die erforderlichen Sicherheits- und Wirksamkeitsstandards erfüllen.
Die PSG sind nicht auf die Entwicklung von Generika beschränkt. Sie decken auch eine breite Palette pharmazeutischer Produkte ab, wie z. B. die folgenden:
- Für neuartige Arzneimittel: Die PSG bieten spezifische Leitlinien für präklinische Studien, die Gestaltung klinischer Studien, die Sicherheitsbewertung, die Pharmakokinetik und die Wirksamkeitsendpunkte. Sie geben den Unternehmen Hinweise zu Art und Umfang der Daten, die zum Nachweis der Sicherheit und Wirksamkeit ihrer innovativen Arzneimittel erforderlich sind.
- Für Biosimilars: In den PSG werden Datenanforderungen, Analysemethoden und Überlegungen zum Design klinischer Studien für Biosimilar-Produkte dargelegt. Wenn sie befolgt werden, können Biosimilar-Unternehmen die Ähnlichkeit ihrer Produkte mit dem Referenzbiologikum nachweisen und so den Weg für die Zulassung und den Marktzugang ebnen.
- Für Biologika: Diese Richtlinien befassen sich mit kritischen Aspekten wie Herstellung, Charakterisierung und Vergleichbarkeitsstudien, um sicherzustellen, dass die Biologika die genehmigten Normen erfüllen.
Entwicklung von produktspezifischen Richtlinien und Prozessen
Die Entwicklung der PSG ist eine gemeinsame Anstrengung, an der HA, wissenschaftliche Experten und Interessenvertreter der Industrie beteiligt sind. Im Folgenden sind die Entwicklungsphasen der PSG aufgeführt:
Stufe 1 - Umfassende Bewertung des Therapiegebiets: Die Gesundheitsbehörden ermitteln Lücken in bestehenden Leitlinien und leiten die Entwicklung von PSG ein, um diese Lücken zu schließen. Wissenschaftliche Experten und Interessenvertreter aus der Industrie werden dann gebeten, ihr Fachwissen einzubringen, um sicherzustellen, dass die Leitlinienentwürfe evidenzbasiert und praktisch umsetzbar sind.
Phase 2 - Öffentliche Konsultation: Die Entwürfe der PSG können nun von der Öffentlichkeit eingesehen und kommentiert werden. Dieser offene und transparente Ansatz ermöglicht es den Interessengruppen, einschließlich Angehörigen der Gesundheitsberufe, Patientengruppen und Vertretern der Industrie, wertvolle Beiträge zu leisten und die Gesamtqualität und Relevanz der Leitlinien zu verbessern.
Stufe 3:Interne Überprüfungsphase: Während sich die Entwürfe der PSG in der öffentlichen Konsultation befinden, führt das PSG-Entwicklungsteam innerhalb der HA eine strenge interne Überprüfung durch, um sicherzustellen, dass die Leitlinien die erforderlichen rechtlichen Anforderungen erfüllen und mit dem breiteren rechtlichen Rahmen übereinstimmen.
Stufe 4 - Fertigstellung: Nach ihrer Fertigstellung werden die PSG veröffentlicht und der Branche zugänglich gemacht. Sie bieten klare und umsetzbare Leitlinien für die Produktentwicklung und -einreichung.
Bestandteile der PSGs
Biowissenschaftsunternehmen müssen die Bestandteile der PSG genau kennen. Das folgende Tortendiagramm veranschaulicht sie im Detail:
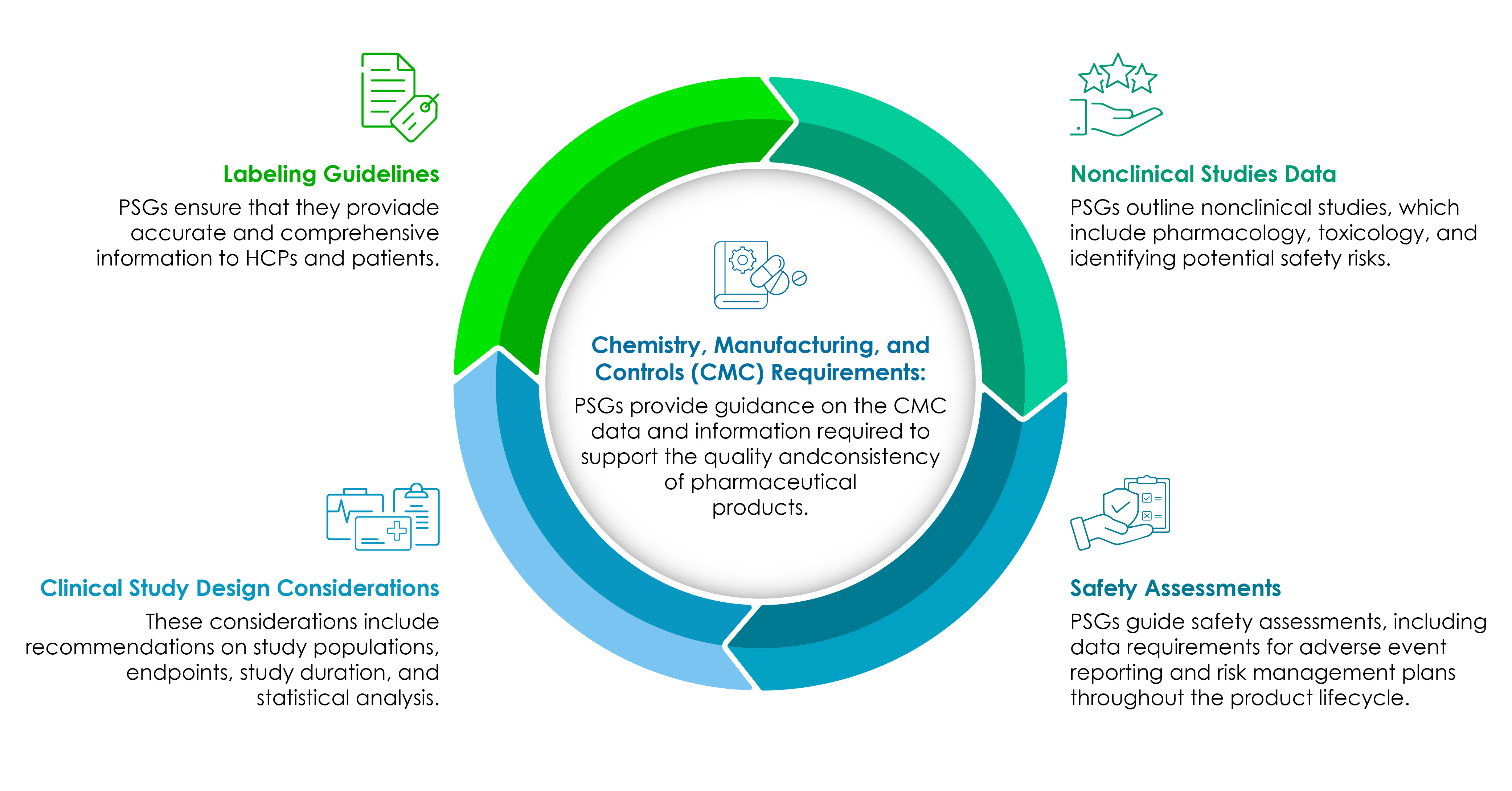
CMC der Kern jeder regulierungsorientierten pharmazeutischen Produktentwicklung.
PSGs navigieren
Eine aufsichtsrechtlich konforme Steuerung der PSG kann durch die nachfolgend aufgeführten Punkte/Strategien erreicht werden:
- Frühzeitige Einbindung der Gesundheitsbehörden: Ein solches Engagement fördert einen kooperativen Ansatz und hilft, potenzielle Herausforderungen proaktiv anzugehen.
- Wissenschaftliches Fachwissen: Der Einsatz von Experten gewährleistet, dass Studiendesigns, Analysemethoden und Sicherheitsbewertungen den höchsten wissenschaftlichen Standards entsprechen.
- Berater für Zulassungsfragen: Die Berater bieten fachkundige Beratung und stellen sicher, dass die Entwicklungspläne und Zulassungsanträge erfolgreich sind.
- Umfassende Überprüfung der PSG: Die Unternehmen sollten die spezifischen PSG-Abschnitte ermitteln, die auf ihr Produkt zutreffen, und ihre Entwicklungspläne entsprechend ausrichten.
- Kontinuierliche Überwachung: PSG sind dynamische Dokumente, die häufig aktualisiert oder überarbeitet werden können. Die Unternehmen müssen die Änderungen in den PSG überwachen, um die Einhaltung der neuesten PSG-Anforderungen zu gewährleisten.
Die fachkundige Anleitung zur Regulierung macht die PSG-Navigation einfach. Jetzt konsultieren!
Schlussfolgerung
Produktspezifische Leitlinien (PSG) bilden das Rückgrat der Zulassungsanträge für pharmazeutische Produkte innerhalb bestimmter therapeutischer Kategorien. Für Life-Sciences-Unternehmen, die ihre Zulassungen beschleunigen, die Produktqualität sicherstellen und sich nahtlos in der globalen Zulassungslandschaft bewegen wollen, ist es entscheidend, die Sichtweise der HA zu verstehen, die hinter der Erstellung der PSG steht.
Als führender Anbieter von regulatorischen Dienstleistungen Freyr der Bedeutung der Einhaltung von Best Practices und der Nutzung von Fachwissen Freyr , das Life-Science-Unternehmen dabei unterstützt, ihre Produktentwicklungsstrategien an die PSG-Anforderungen anzupassen. Kontaktieren us noch heute, um mehr über unsere Dienstleistungen zu erfahren und zu erfahren, wie wir Ihnen helfen können, Ihre Ziele zu erreichen.









