
Für Pharmaunternehmen ist es aufgrund der sich ständig ändernden weltweiten Vorschriften und Gesetze schwierig, alle bestehenden globalen regulatorischen Anforderungen zu kennen. Aufgrund des internationalen Harmonisierungsprozesses werden ständig neue Verfahren entwickelt und von den Aufsichtsbehörden weltweit übernommen.
GESCHICHTE DER REGULATORISCHEN INTELLIGENZ (RI)
RI ist RI Teil der globalen Abteilung für Regulatory Affairs eines Unternehmens und erweitert die traditionellen Aufgaben im Bereich Regulatory Affairs über die Vorbereitung und Einreichung von Anträgen bei der FDA den Aufsichtsbehörden in Europa und Asien hinaus.
Die Führungskräfte des Unternehmens werden über die aktuellen Vorschriften, die sich auf die Entwicklung, Zulassung und Wartung von Produkten auswirken, sowie über alle Änderungen der Vorschriften und/oder der Vorschriftenlandschaft, die sich auf ihre Arbeit auswirken könnten, informiert.
RI zum Geschäftsergebnis jedes Pharmaunternehmens RI , indem RI die Teams für regulatorische Angelegenheiten dabei unterstützt, den Behörden Unterlagen von höchster Qualität vorzulegen. Unternehmen müssen darüber hinaus neben den regulatorischen Vorgaben auch die Faktoren verstehen, die die Prüfung von Zulassungsanträgen für neue Medikamente in den einzelnen Märkten weltweit beeinflussen.
DAS REGULATORISCHE UMFELD
Die ständigen Veränderungen im regulatorischen Umfeld erfordern, dass alle Beteiligten/Behörden mit den aktuellen Informationen aus einer Vielzahl von Quellen auf dem Laufenden sind. Fachleute für Regulierungsangelegenheiten können Praktiken der Branche, Stellungnahmen der Regulierungsbehörden und Informationen über Wettbewerber nutzen, um erfolgreiche Regulierungsstrategien zu entwickeln.
REGULATORISCHE INTELLIGENZ (RI)
RI die Sammlung und Analyse von regulatorischen Informationen hinsichtlich der Auswirkungen oder Änderungen von Gesetzen, Vorschriften, Richtlinien, Leitfäden usw. RI einem Regulatory Professional, Mitarbeiter zu beraten, strategische regulatorische Fragen zu beantworten und einen globalen Marketingantrag zu verfassen oder zu erstellen sowie die Anforderungen für die Durchführung globaler klinischer Studien und die Herstellung festzulegen.
RI Einblicke in die Beschaffung, Filterung, Analyse und Anwendung von Informationen, um wertvolle regulatorische Informationen zu generieren. Regulatory Intelligence folgt einem systematischen Prozess, um die Funktionen innerhalb der Regulatory Affairs zu optimieren.
WIE KÖNNEN SIE VON REGULATORISCHER INTELLIGENZ PROFITIEREN?
Vor der Beantragung von klinischen Zulassungen stellt die Abteilung für Zulassungsangelegenheiten einige Fragen, um die Vor- und Nachteile der Einführung eines bestimmten Arzneimittels/Produkts in verschiedenen Regionen und andere Compliance-Anforderungen zu untersuchen. Die Forschungsfragen orientieren sich an den geschäftlichen Erfordernissen und sind mit Entscheidungen und Maßnahmen verbunden.
Der Regulatory Intelligence-Prozess ermöglicht eine flexible Forschungsanalyse. Er deckt umfassend die gesamte Produktpalette ab, darunter: Arzneimittel, Medizinprodukte, Biologika, Tierarzneimittel, Verbraucher- und OTC sowie Nutrazeutika.
Die regulatorischen Informationen umfassen: Neue Richtlinien, Änderungen von Richtlinien, pharmazeutische Entwicklung, Herstellung, Qualität, klinische und nichtklinische Aspekte, Stabilität und Lagerung, Validierung, Verpackung und Kennzeichnung, pharmazeutische Hilfsstoffe, Verunreinigungen, Artwork Rückrufwarnungen,Sicherheit und Pharmakovigilanz, Warnhinweise, Einreichungsformate und vieles mehr.
GLOBALE REGULIERUNGSSTRATEGIE: BEDEUTUNG
Veränderungen in der globalen Landschaft können sich auf die globale Regulierungsstrategie auswirken, da immer mehr Unternehmen weltweit Studien durchführen und Zulassungsanträge stellen. RI vergleichen die regulatorischen Entwicklungen in verschiedenen Ländern, bewerten die Angemessenheit bestehender regulatorischer Rahmenbedingungen im Hinblick auf die neuesten technologischen Entwicklungen oder führen regulatorische Analysen im Rahmen von Due-Diligence-Berichten durch.
RECHTSVORRANG
Eine Regulierungsstrategie kann durch Überwachung und Erfassung von RI entwickelt werden, RI zu folgenden Ergebnissen führen kann:
- Verkürzte Zeit bis zur Genehmigung
- Maximierung der Zielmärkte
- Geringere Kosten für die Produktentwicklung auf der Grundlage aktueller Informationen
QUELLEN FÜR REGULATORISCHE INFORMATIONEN
Vorrangige Rechtsvorschriften | Praktiken der Industrie | Stellungnahmen der Aufsichtsbehörde | Websites der Behörde | Leitfäden | E-Mails von Websites der Aufsichtsbehörde | Interaktionen mit Prüfern der Behörde | Warnschreiben | Kollegen & Berater | FOI-Anfragen | Informationen von Mitbewerbern | Einschlägige Fachzeitschriften & Newsletter | Einschlägige Konferenzen | Beratungssitzungen | Interaktionen mit anderen Fachleuten aus dem Bereich der Regulierung
PHARMAUNTERNEHMEN UND REGULATORISCHE INFORMATIONEN
Führende Pharmaunternehmen evaluieren neue Geschäftsmodelle einschließlich alternativer Informationsmanagement-Plattformen, um die Kosten zu senken, die Fristen zu verkürzen und die Qualität und die Einhaltung der Vorschriften zu gewährleisten. Im derzeitigen regulatorischen Klima haben die meisten Pharmaunternehmen Schwierigkeiten, die Produktivität in Forschung und Entwicklung aufrechtzuerhalten.
Die Pharmaunternehmen sind sehr daran interessiert, neue Modelle für die Arzneimittelentwicklung zu erforschen, mit denen die Entwicklungskosten gesenkt, die Fristen verkürzt und dennoch die Qualität und die Einhaltung der Vorschriften gewährleistet werden können. Sie beabsichtigen, diese Gewinne zu realisieren, indem sie sich langsam an neue Geschäftsmodelle für das Daten- und Regulierungsmanagement herantasten.
Innovative Informationsmanagement-Plattformen, die den gesamten Umfang der regulatorischen und klinischen Datenoperationen mit Unterstützung aller geografischen Regionen und Aufsichtsbehörden verwalten können, werden von Pharmaunternehmen erforscht. Informationsmanagement-Plattformen machen Forschungsdaten durch die Standardisierung der Erfassung, Formatierung und Verteilung besser verfügbar und bieten einzigartige Perspektiven für den Untersuchungsprozess.
Mithilfe von Analysetools und -techniken können Forscher Modellergebnisse liefern, Trends erkennen und die richtigen Fragen stellen, was wiederum den Unternehmen hilft, Prozesse zu standardisieren und zu optimieren. Die Bemühungen um die Umgestaltung von Prozessen werden mehr Aktivitäten in den Bereichen Regulierung, Pharmakovigilanz und klinische Prozesse umfassen.
Diese wiederum werden durch integrierte Technologie- und Analysekapazitäten unterstützt, die eine globale Einhaltung von Vorschriften ermöglichen. Die rasche Umstellung auf die Modernisierung ihrer Entwicklungsabläufe dient zum Teil der Abschaffung veralteter Entwicklungsmodelle, insbesondere interner Technologielösungen, die wiederum verlangsamte Wachstumsraten ausgleichen werden, um unter dem Strich Ergebnisse zu erzielen.
BUSINESS INTELLIGENCE UND PHARMAINDUSTRIE
Angesichts der sich ändernden Vorschriften und der Einhaltung von Bestimmungen stehen Pharmaunternehmen gleichzeitig vor der Herausforderung, Kosten zu senken, die Einnahmen und die betriebliche Effizienz zu steigern, die Kosten für die Lieferkette zu senken und gleichzeitig die Vorschriften und Sicherheitsanforderungen zu erfüllen. Pharmaunternehmen können Business Intelligence-Software strategisch nutzen, um fundierte Geschäftsentscheidungen zu treffen.
Die Business-Intelligence-Software kann über die Business-Intelligence-Architektur große Datenmengen analysieren, berichten und überwachen und Unternehmen dabei helfen, Kosten zu senken, den Umsatz zu steigern und den Wert der Informationen zu maximieren.
RI FÜR UNTERNEHMEN
Große und mittelgroße Unternehmen mit Produkten auf vielen Märkten stehen vor der definitiven Herausforderung, verbindliche Informationen über Rechtsvorschriften von Regulierungsbehörden zu erhalten. Die Unternehmen gehen davon aus, dass die Regulatory Intelligence Groups eine verbindliche Auslegung einer Vielzahl nationaler und regionaler Vorschriften liefern. Darüber hinaus muss die Gruppe auch eine Folgenabschätzung der vorgeschlagenen regulatorischen Änderungen in vielen weiteren Märkten liefern.
RI : SCHWACHSTELLEN
In einer Umfrage aus dem Jahr 2014 zu zentralisierten RI schätzten die Befragten die Produkte der RI sehr, waren jedoch wenig zufrieden damit.
• Das zentrale RI befindet sich in der Regel in der Unternehmenszentrale und wird von dort aus verwaltet.
durch einen relativ kleinen Mitarbeiterstab
• Die Arbeit der zentralen RI ist oft relativ breit gefächert und mit kritischen Aufgaben verbunden.
- Steigende Anforderungen an Informationen und Audits durch die Gesundheitsbehörden
- 67 % der Unternehmen haben ein zentrales Büro/Programm für regulatorische Informationen eingerichtet.
• Ein Viertel antwortete mit „Ja“, als gefragt wurde, ob das zentralisierte RI als
die maßgebliche Quelle für *harte und weiche Nachrichtendienste
*Zu den harten und weichen Nachrichtendiensten gehören zentrale RI wie die Auslegung von Gesetzen, HA-Vorschriften und Leitlinien.
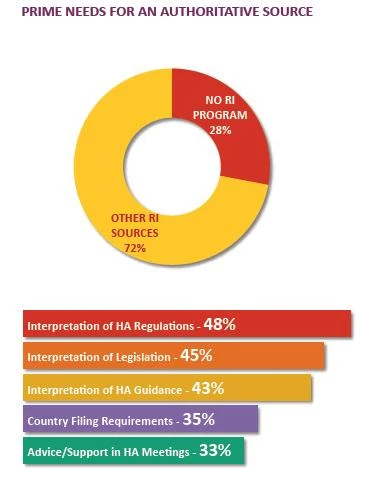
GRÜNDE, WARUM KLEINERE UNTERNEHMEN RI ALS AUTORITATIVE QUELLE ANGEBEN
- Heranziehung anderer interner Experten zur Erstellung einer vollständigen Analyse von Vorschriften oder Leitlinien
- Einige Stakeholder stützen sich auf interne Netzwerke und externe Quellen, um eine Stellungnahme und einen Aktionsplan zur Erfüllung neuer rechtlicher Anforderungen zu entwickeln
UNTERNEHMEN PLANEN EINEN WECHSEL IN
PROZESS: Verbesserung der internen Kommunikation zwischen der zentralen Gruppe, den mit der Regulierung betrauten Tochtergesellschaften und den Funktionsbereichen
WERKZEUGE FÜR DAS MANAGEMENT VON INFORMATIONSPROZESSEN: Verbesserung des Informationszugangs durch Portale, Wissensmanagementsysteme und externe Tools
AUFGABEN UND VERANTWORTLICHKEITEN: Organisatorische Veränderungen - Ermittlung und Verbesserung der Leistungen zur Steigerung der Zufriedenheit der Interessengruppen
REGULATORISCHE INTELLIGENZ - LANGFRISTIGER STRATEGISCHER NUTZEN
- Überwachung des rechtlichen Umfelds und Gewährleistung der Einhaltung der Vorschriften
- Spart Zeit und Geld durch die Erfassung, Analyse und Verbreitung von Informationen in Echtzeit
- Vermeidet das Risiko von Doppelarbeit und Redundanzen
- Überwindung der weltweiten Sprachbarriere durch sofortigen Zugriff auf wichtige Details in englischer Sprache
- Gewährleistet die Richtigkeit wichtiger Informationen, die von Händlern, Herstellern und anderen
Branchenkontakten eingeholt werden
- pflegt die Wissensdatenbank, indem er das Wissen über Rechtsvorschriften
innerhalb des Unternehmens aufbewahrt und ständig ergänzt
-Unterstützung bei der Schaffung einer soliden Regulierungspolitik
- Überprüfung und Aktualisierung der alten Daten mit den aktuellen Trends in der Gesetzgebung
- Beratung der Belegschaft in verschiedenen sich neu entwickelnden Regulierungsbereichen
- Bietet detaillierte und individuelle Einblicke für die erweiterte Suche
- Bietet ein zentralisiertes und strukturiertes Informationsmanagementsystem
SCHLUSSFOLGERUNG
Alle Unternehmen betreiben in gewissem Umfang Regulatory Intelligence, und immer mehr Unternehmen richten spezielle Intelligence-Gruppen ein. Der Umfang der "Regulatory Intelligence" variiert in Form von aktiven Analysen und Interpretationen, ist jedoch nicht gleichzusetzen mit regulatorischen Informationen.
Darüber hinaus sind Informationen über die Rechtsvorschriften sowie die Zuweisung von Schlüsselaufgaben unerlässlich, um die Einhaltung der Vorschriften, das Bewusstsein für die Zukunft und angemessene Ressourcen sicherzustellen. Die Vorteile, die sich aus dem Vorhandensein korrekter regulatorischer Informationen ergeben, ermöglichen es, eine gute regulatorische Strategie zu entwerfen und umzusetzen, die zu einer kürzeren Markteinführungszeit sowohl durch eine beschleunigte Entwicklung als auch durch eine reibungslosere Zulassungsprüfung, geringere Kosten, eine bessere Einhaltung der Vorschriften und letztlich eine Optimierung der Investitionsrendite führen kann.









