
Kombinationsprodukte, die Arzneimittel, Geräte und/oder biologische Produkte integrieren, haben die Gesundheitsversorgung durch innovative therapeutische Lösungen revolutioniert. Ihre Einzigartigkeit stellt die Regulierungsbehörden jedoch vor große Herausforderungen. Dieser umfassende Leitfaden untersucht die komplizierte Landschaft der Regulierung von Kombinationsprodukten und bietet Strategien für eine erfolgreiche Navigation durch diese komplexen Pfade.
Verständnis von Kombinationsprodukten und ihrem regulatorischen Rahmen
Kombinationsprodukte sind Medizinprodukte, die zwei (2) oder mehr regulierte Komponenten – Arzneimittel, Medizinprodukte oder Biologika – in einer einzigen Einheit vereinen. Diese innovativen Produkte können verschiedene Formen annehmen, beispielsweise medikamentenbeschichtete Stents, Fertigspritzen oder transdermale Pflaster. Der regulatorische Rahmen für Kombinationsprodukte wird in erster Linie von der US-amerikanischen Food and Drug Administration (FDA) vorgegeben, wobei ähnliche Ansätze von Regulierungsbehörden weltweit übernommen werden.
Das Office of Combination Products (OCP) FDA spielt eine entscheidende Rolle bei der Bestimmung der primären Wirkungsweise (PMOA) eines Kombinationsprodukts, die den Regulierungsweg und die für die Überprüfung zuständige FDA festlegt. Das Center for Drug Evaluation and Research (CDER), das Center for Devices and Radiological Health (CDRH) und das Center for Biologics Evaluation and Research (CBER) arbeiten bei der Überprüfung zusammen und betonen die Notwendigkeit eines integrierten Ansatzes, um die Sicherheit und Wirksamkeit von Kombinationsprodukten zu gewährleisten.
Bestimmung des Regulierungsweges
Einer (1) der wichtigsten Schritte bei der Entwicklung einer Zulassungsstrategie für Kombinationsprodukte ist die Festlegung des geeigneten Zulassungsweges. Diese Entscheidung basiert in erster Linie auf dem PMOA des Produkts. Hier sind die wichtigsten Überlegungen:
- Primäre Wirkungsweise (PMOA): Geben Sie die einzelne Wirkungsweise an, die die wichtigste therapeutische Wirkung des Kombinationsprodukts darstellt.
- Zuweisung des federführenden Zentrums: Auf der Grundlage des PMOA wird das Produkt dem CDER, CDRH oder CBER zur primären Prüfung zugewiesen.
- Art des Zulassungsantrags: Je nach federführendem Zentrum kann der Antrag in Form eines Antrags auf Zulassung eines neuen Arzneimittels (NDA), eines Antrags auf Zulassung eines biologischen Arzneimittels (BLA LicenseBLA) oder eines Antrags auf Premarket Approval (PMA) gestellt werden.
- Antrag auf Benennung (RFD): Wenn die PMOA unklar ist, können Sponsoren einen RFD bei der OCP einreichen, um eine formale Entscheidung zu treffen.
- Vorab-Antrag auf Benennung (Pre-RFD): Die OCP kann einen Pre-RFD für ein informelles, unverbindliches Feedback zu Einstufungs- und Zuständigkeitsfragen erhalten.
Das Verständnis dieser Faktoren ist entscheidend für die Entwicklung einer wirksamen Regulierungsstrategie, die auf Ihr spezifisches Kombinationsprodukt zugeschnitten ist.
Navigieren durch die Verfahren der Vormarktprüfung
Das Verfahren zur Prüfung vor der Markteinführung von Kombinationsprodukten kann sehr komplex sein und erfordert eine sorgfältige Planung und Durchführung. Hier sind die wichtigsten Strategien, um diesen Prozess effektiv zu durchlaufen:
- Frühzeitige Einbindung der Aufsichtsbehörden: Nehmen Sie FDA in FDA des Entwicklungsprozesses Gespräche mit der FDA auf, indem Sie vorab Besprechungen vereinbaren. Diese Gespräche können wertvolle Hinweise zu behördlichen Anforderungen, Studiendesigns und potenziellen Herausforderungen liefern.
- Umfassender Entwicklungsplan: Entwickeln Sie einen soliden Plan, der die einzigartigen Aspekte Ihres Kombinationsprodukts berücksichtigt, einschließlich der Wechselwirkungen zwischen den einzelnen Bestandteilen und ihrer kombinierten Auswirkungen auf Sicherheit und Wirksamkeit.
- Integrierter Testansatz: Konzipieren Sie präklinische und klinische Studien, in denen die einzelnen Komponenten und das gesamte Kombinationsprodukt bewertet werden. Dieser Ansatz sollte potenzielle Wechselwirkungen und kumulative Wirkungen bewerten.
- Überlegungen zum Qualitätssystem: Implementieren Sie ein Qualitätssystem, das den Vorschriften für Arzneimittel (21 CFR 210/211) und Medizinprodukte (21 CFR 820) entspricht, die für Ihr Produkt gelten.
- Human Factors Engineering: Einbeziehung von Studien zu menschlichen Faktoren, um die Interaktionen der Benutzer mit dem Kombinationsprodukt zu bewerten und eine sichere und effektive Nutzung zu gewährleisten.
- Risikomanagement: Entwickeln Sie einen umfassenden Risikomanagementplan, der sich mit den potenziellen Risiken der einzelnen Komponenten und ihrer Kombination befasst.
Durch die Anwendung dieser Strategien können die Sponsoren das Verfahren zur Prüfung vor der Markteinführung straffen und die Wahrscheinlichkeit des Erfolgs bei der Zulassung erhöhen.
Bewältigung von Herausforderungen nach der Markteinführung
Die regulatorischen Verantwortlichkeiten für Kombinationsprodukte gehen über die Marktzulassung hinaus. Eine wirksame Überwachung nach dem Inverkehrbringen und die Einhaltung der Vorschriften sind für den langfristigen Erfolg von entscheidender Bedeutung. Berücksichtigen Sie die folgenden Strategien:
- Integrierte Pharmakovigilanz: Implementierung eines robusten Pharmakovigilanzsystems, das unerwünschte Ereignisse im Zusammenhang mit den Arzneimittel- und Produktkomponenten des Kombinationsprodukts erfasst.
- Studien nach der Markteinführung: Planung und Durchführung von Studien nach der Markteinführung, um zusätzliche Sicherheits- und Wirksamkeitsdaten zu sammeln, insbesondere für neuartige Kombinationsprodukte.
- Wartung des Qualitätssystems: Aktualisieren und pflegen Sie Ihr Qualitätssystem kontinuierlich, um die Einhaltung der einschlägigen Vorschriften für Arzneimittel- und Gerätekomponenten zu gewährleisten.
- Änderungsmanagement: Einführung eines unkomplizierten Verfahrens für die Verwaltung von Änderungen nach der Zulassung unter Berücksichtigung der möglichen Auswirkungen auf die Arzneimittel- und Produktaspekte des Produkts.
- Regulatorische Informationen: Bleiben Sie auf dem Laufenden über neue Vorschriften und Leitfäden im Zusammenhang mit Kombinationsprodukten, um die Einhaltung der Vorschriften zu gewährleisten.
Durch die proaktive Bewältigung dieser Herausforderungen nach der Markteinführung können Hersteller die Einhaltung von Vorschriften und die Produktsicherheit während des gesamten Produktlebenszyklus gewährleisten.
Globale regulatorische Erwägungen
Da der Markt für Kombinationsprodukte weltweit expandiert, wird das Verständnis der internationalen Zulassungsanforderungen immer wichtiger. Berücksichtigen Sie diese Strategien für den Erfolg bei globalen Zulassungen:
- Regulatorische Harmonisierung: Nutzen Sie die internationalen Harmonisierungsbemühungen, z. B. des International Medical Device Regulators Forum (IMDRF), um die Einreichung von Zulassungsanträgen weltweit zu vereinfachen.
- Marktspezifische Anforderungen: Recherchieren Sie die spezifischen Anforderungen für Kombinationsprodukte in den Zielmärkten und machen Sie sich mit ihnen vertraut, da die Vorschriften von Land zu Land sehr unterschiedlich sind.
- Gleichzeitige Einreichungen: Ziehen Sie gegebenenfalls gleichzeitige Einreichungen bei mehreren Regulierungsbehörden in Betracht, um den globalen Marktzugang zu beschleunigen.
- Globale klinische Studien: Entwerfen Sie klinische Studien, die die Anforderungen mehrerer Zulassungsbehörden erfüllen, um weltweite Vermarktungsanträge zu unterstützen.
- Internationale Partnerschaften: Arbeiten Sie mit lokalen Regulierungsexperten oder Partnern in den Zielmärkten zusammen, um die länderspezifischen Vorschriften und kulturellen Aspekte zu berücksichtigen.
Durch eine globale Perspektive bei der Entwicklung ihrer Regulierungsstrategie können Hersteller ihre reach Kombinationsprodukte effektiver ausbauen.
Schlussfolgerung
Das Navigieren durch die Zulassungswege für Kombinationsprodukte erfordert ein umfassendes Verständnis der komplexen regulatorischen Rahmenbedingungen und eine strategische Planung.
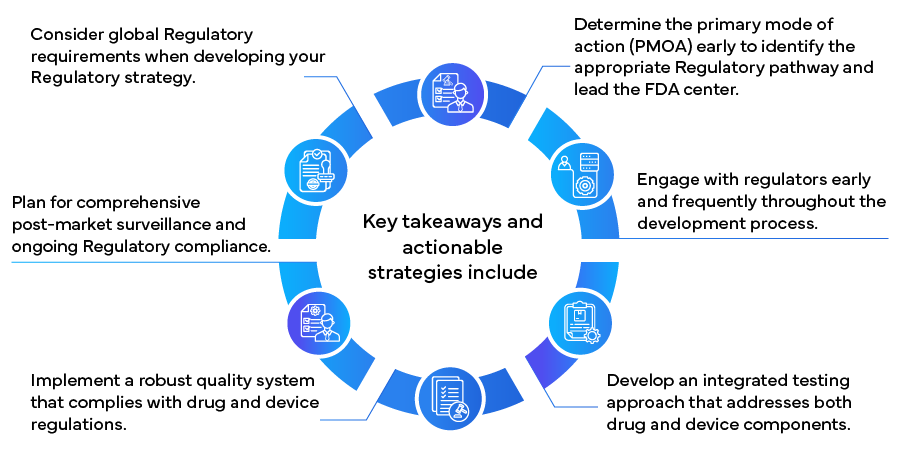
Durch die Umsetzung dieser Strategien können Hersteller das komplexe regulatorische Umfeld für Kombinationsprodukte effektiver steuern, die Markteinführung potenziell beschleunigen und die langfristige Einhaltung der Vorschriften und den Erfolg sicherstellen. Da sich der Bereich der Kombinationsprodukte ständig weiterentwickelt, ist es für den anhaltenden Erfolg in diesem innovativen und schnell wachsenden Gesundheitssektor von entscheidender Bedeutung, über regulatorische Änderungen auf dem Laufenden zu bleiben und bei den regulatorischen Ansätzen flexibel zu bleiben.









