
In den letzten Jahren hat sich in der Gesundheits- und Biowissenschaftsbranche ein deutlicher Wandel hin zu patientenorientierten Ansätzen in der Zulassungspraxis vollzogen. Mit diesem Paradigmenwechsel wird anerkannt, wie wichtig es ist, die Perspektiven, Erfahrungen und Bedürfnisse der Patienten in die Entwicklung und Bewertung von medizinischen Produkten einzubeziehen. In dieser sich wandelnden Landschaft ist es von entscheidender Bedeutung zu verstehen, wie die Patientenzentrierung die Regulierungsstrategien umgestaltet und gleichzeitig ein empfindliches Gleichgewicht zwischen Innovation und Sicherheit aufrechterhält.
Die Entwicklung patientenorientierter Zulassungsangelegenheiten
Das Konzept der Patientenzentrierung im Bereich der Regulierungsangelegenheiten hat sich seit seinen Anfängen stark weiterentwickelt. Ursprünglich konzentrierten sich die Zulassungsprozesse auf die Erfüllung strenger Anforderungen und die Erteilung von Marktzulassungen. Die Branche hat jedoch erkannt, wie wichtig es ist, den Beitrag der Patienten während des gesamten Produktlebenszyklus einzubeziehen.
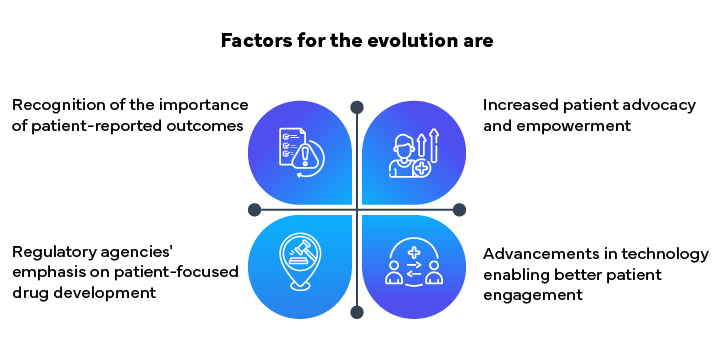
Die Initiative „Patient-Focused Drug Development“ (PFDD) FDA ist ein Paradebeispiel für diesen Wandel. Sie zielt darauf ab, systematisch die Sichtweisen von Patienten zu ihren Erkrankungen und den verfügbaren Behandlungen zu sammeln. In ähnlicher Weise hat die Europäische Arzneimittelagentur (EMA) Rahmenwerke wie „Adaptive Pathways“ eingeführt, um patientenorientierte Praktiken zu unterstützen.
Schlüsselelemente patientenorientierter Regulierungsansätze
Die Umsetzung eines patientenzentrierten Ansatzes in der Regulierung umfasst mehrere Schlüsselelemente:
- Frühzeitige Einbeziehung der Patienten: Durch die Einbeziehung von Patienten in den frühesten Phasen der Produktentwicklung wird sichergestellt, dass die Regulierungsstrategien den Bedürfnissen der Patienten entsprechen.
- Patientenzentrierte klinische Studien: Eine patientenorientierte Gestaltung von Studien kann zu relevanteren Ergebnissen und besseren Rekrutierungs- und Bindungsraten führen.
- Beweise aus der realen Welt: Die Nutzung von Daten aus elektronischen Gesundheitsakten, Patientenregistern und tragbaren Geräten bietet einen umfassenden Überblick über die Leistung eines Produkts unter realen Bedingungen.
- Patientenfürsorge und Aufklärung: Durch die Zusammenarbeit mit Patientenvertretungen wird sichergestellt, dass genaue und verständliche Informationen zur Verfügung stehen.
- Zusammenarbeit mit den Aufsichtsbehörden: Zusammenarbeit mit den Aufsichtsbehörden, um sicherzustellen, dass die Erfahrungen und Präferenzen der Patienten bei den Bewertungen berücksichtigt werden.
Gleichgewicht zwischen Innovation und Sicherheit
Während patientenorientierte Ansätze Innovationen vorantreiben, ist es entscheidend, den Fokus auf Sicherheit zu behalten. Aufsichtsbehörden wie die FDA dem rasanten Innovationstempo im Bereich der Biowissenschaften FDA und optimieren Verwaltungsprozesse, um die Zulassung von Arzneimitteln zu beschleunigen. Dennoch bleibt es eine Gratwanderung zwischen Schnelligkeit und Sicherheit.
Um dieses Gleichgewicht zu halten, müssen die Unternehmen der Biowissenschaften:
- Umsetzung strenger Qualitätskontrollprogramme
- Sicherstellung der Abstimmung zwischen Vertrieb, Marketing und Regulierungsteams
- Wachsamkeit gegenüber sich entwickelnden Vorschriften in allen Ländern, in denen wir tätig sind
- Enge Zusammenarbeit mit Aufsichtsbehörden
Die Auswirkungen der Technologie auf die patientenzentrierte Regulierung
Der technologische Fortschritt spielt eine wichtige Rolle bei der Gestaltung patientenorientierter Regulierungsansätze. Intelligente Geräte, Telemedizin und künstliche Intelligenz verändern die Gesundheitsversorgung und die Forschung. Diese Technologien bieten neue Möglichkeiten für die Einbindung von Patienten und die Datenerfassung, bringen aber auch neue Herausforderungen mit sich, wie z. B. Cybersicherheitsrisiken, Bedenken hinsichtlich des Datenschutzes und Herausforderungen bei der Integration. Um diese Herausforderungen zu bewältigen, müssen Biowissenschaftsunternehmen folgende Maßnahmen ergreifen robuste Cybersicherheitsmaßnahmen, die Einhaltung mit Datenschutzbestimmungenund arbeiten eng mit den Aufsichtsbehörden zusammen, um geeignete Rahmenbedingungen für neue Technologien zu entwickeln.
Vorteile und Herausforderungen patientenorientierter Regulierungsansätze
Die Einführung patientenorientierter Regulierungsstrategien bietet zahlreiche Vorteile:
- Schnellere Genehmigungen: Patientenzentrierte klinische Studiendesigns und die Sammlung von Beweisen aus der Praxis können zu schnelleren Zulassungen führen.
- Verbesserte Produktentwicklung: Die Kenntnis der Patientenpräferenzen führt zu wirksameren Produkten, die besser auf die Erwartungen der Patienten abgestimmt sind.
- Verbesserter Marktzugang: Die Zulassungsbehörden könnten eher geneigt sein, beschleunigte Prüfverfahren für patientenzentrierte Ansätze zu gewähren.
- Höhere Patientenzufriedenheit: Patienten, die sich während des gesamten Entwicklungs- und Zulassungsprozesses gehört und wertgeschätzt fühlen, sind mit dem Endprodukt eher zufrieden.
Die Umsetzung patientenorientierter Ansätze ist jedoch auch mit Herausforderungen verbunden:
- Ausgleich zwischen wissenschaftlicher Strenge und Patientenfreundlichkeit: Sicherstellen, dass patientenorientierte Änderungen die wissenschaftliche Integrität nicht beeinträchtigen.
- Kosten und Ausbildung: Die Integration neuer Technologien und Ansätze kann kostspielig sein und umfangreiche Schulungen erfordern.
- Standardisierung: Schwierigkeiten bei der Standardisierung der von den Patienten gemeldeten Ergebnisse in unterschiedlichen Patientengruppen.
- Langfristige Bindung aufrechterhalten: Es kann eine Herausforderung sein, die Patienten über eine lange Studiendauer hinweg bei der Stange zu halten.
Schlussfolgerung
Das Aufkommen patientenorientierter Zulassungsansätze stellt einen bedeutenden Wandel in der Biowissenschaftsbranche dar. Indem sie die Perspektive und die Erfahrungen der Patienten in den Vordergrund stellen, können die Unternehmen wirksamere Produkte entwickeln, die Zulassungsprozesse straffen und die Ergebnisse für die Patienten verbessern. Dieser Ansatz erfordert jedoch eine sorgfältige Navigation, um ein Gleichgewicht zwischen Innovation, Sicherheit und Einhaltung der Vorschriften herzustellen.
Mit diesen patientenzentrierten Ansätzen können Life-Sciences-Unternehmen das komplexe regulatorische Umfeld besser bewältigen und den Patienten schneller innovative und sichere Behandlungen anbieten. Da sich die Branche weiter entwickelt, wird es für den langfristigen Erfolg in der dynamischen Welt des Gesundheitswesens und der Biowissenschaften entscheidend sein, die Bedürfnisse der Patienten im Auge zu behalten und gleichzeitig die Einhaltung der Vorschriften zu gewährleisten.









