
Notfallzulassungen (Emergency Use Authorizations, EUAs) sind wichtig, um lebensrettende Arzneimittel schneller für Patienten verfügbar zu machen. Sie haben sich bei der Bekämpfung von Pandemien wie COVID-19 als hilfreich erwiesen. Eine Initiative der US-amerikanischen Food and Drug Administration (USFDA) wurde im Jahr 2004 ins Leben gerufen, und die EUA trat in Kraft, als Abschnitt 564 des Federal Food, Drug, and Cosmetic Act durch den Project BioShield Act geändert wurde. Dieses Programm ist eine Maßnahme der FDA Schutz der öffentlichen Gesundheit, indem es die Sicherheit, Wirksamkeit und Qualität von Medizinprodukten gewährleistet und gleichzeitig medizinische Notfälle und neue Bedrohungen für die öffentliche Gesundheit bekämpft.
Lassen Sie us dies in den folgenden Zeilen besser us .
Entschlüsselung der EUA
Der EUA-Weg ist ein Mittel, um in Zeiten erklärter Notfälle den Zugang zu medizinischen Gegenmaßnahmen zu erleichtern. Der Kommissar der FDA in solchen Situationen Folgendes genehmigen:
- Die genehmigte Verwendung von nicht zugelassenen medizinischen Produkten.
- Die unerlaubte Verwendung von zugelassenen medizinischen Produkten.
Zu den Produkten, die unter die EUA fallen, gehören Impfstoffe, intravenöse Flüssigkeiten, Arzneimittel, Geräte, Tests usw., die zur Diagnose, Behandlung oder Vorbeugung lebensbedrohlicher Krankheiten verwendet werden können. Produkte erhalten eine EUA, wenn die folgenden Kriterien erfüllt sind:
- Nachweis eines lebensbedrohlichen Zustands/einer lebensbedrohlichen Krankheit.
- Die wissenschaftlichen Daten liefern genügend Beweise dafür, dass das Produkt für den vorgesehenen Verwendungszweck wirksam ist.
- Die Vorteile des Produkts überwiegen die Risiken (aka Sicherheitsnachweis).
- Mangel an alternativen Produkten.
Sponsoren wird empfohlen, sich vorab mit den Anforderungen FDAvertraut zu machen, damit sie den besten Regulierungsprozess befolgen und eine fehlerfreie Einreichung des Antrags auf Notfallzulassung (EUA) sicherstellen können. Nachfolgend sind die obligatorischen Informationen aufgeführt, die der Sponsor im Antrag angeben muss.
Vom Sponsor bei der FDA eine Notfallzulassung einzureichende Daten
- Beschreibung des Produkts und seines Verwendungszwecks.
- Der Zulassungsstatus des Produkts bei der FDA.
- Informationen zur Sicherheit und Wirksamkeit wie klinische und nicht-klinische Daten usw.
- Bericht zur Risiko-Nutzen-Analyse.
- Daten zu Chemie, Herstellung und Kontrollen (CMC).
- Informationen zu Dosierung, Gegenanzeigen, Warnhinweisen und unerwünschten Ereignissen für den Vertrieb des betreffenden Medizinprodukts.
Wie werden EUAs von der FDA ausgestellt?
Im Folgenden wird der EUA-Lebenszyklus in einer schematischen Darstellung kurz erläutert:
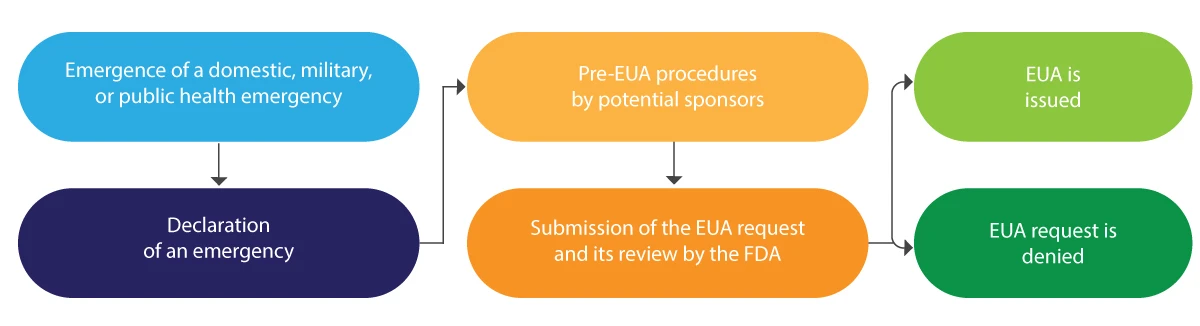
Die EUA wird in der Regel für einen begrenzten Zeitraum erteilt und am Ende des genannten Notfalls von der FDA aufgehoben.
EUA und COVID-19
Der Minister für Gesundheit und Humanwissenschaften (HHS) erklärte COVID-19 am 31. Januar 2020 zur Pandemie. Seitdem FDA die FDA maßgeblich dazu beigetragen, einige Impfstoffe und Heimtest-Kits im Rahmen des EUA-Verfahrens zuzulassen, um der anhaltenden globalen Pandemie zu begegnen.
Angesichts des Auftretens neuer Varianten von COVID-19 arbeitet die gesamte Pharmaindustrie intensiv daran, die Ausbreitung einzudämmen und die Sterblichkeitsraten zu senken. Es besteht Bedarf an neuartigen Arzneimitteln und einer schnelleren Zulassung durch die globalen Regulierungsbehörden, damit deren Markteinführung beschleunigt werden kann. Nach Ansicht von Experten ist die EUA-Regelung zur Zulassung neuer Arzneimittel der richtige Weg. Mehrere andere Gesundheitsbehörden wie die Europäische Arzneimittelagentur (EMA), die Central Drugs Standard Control Organization CDSCO), die Saudi Food and Drug Authority SFDA) usw. haben ebenfalls den EUA-Weg für schnellere Zulassungen eingeführt.
Wenn Sie ein Arzneimittelhersteller sind und eine Notfallzulassung (EUA) für Ihr lebensrettendes Produkt beantragen möchten, benötigen Sie einen kompetenten Anbieter von regulatorischen Lösungen. Reach an Freyr eine schnellere Markteinführung und einen konformen Weg Freyr .









