
Pharmaunternehmen, die nach neuen Geschäftsperspektiven suchen, finden in Südkorea einen attraktiven Markt mit einer schnell wachsenden Pharmaindustrie. Mit über neunhundert (900) neuen Medikamenten in der Pipeline und Exporten im Wert von 3,1 Mrd. USD bietet Südkorea ein enormes Potenzial für die Herstellung großer Pharmazeutika.
In Südkorea ist die Einreichung eines Antrags auf Zulassung eines neuen Arzneimittels (New Drug Application,NDA) oder eines Antrags auf Zulassung eines biologischen Arzneimittels (Biologics License Application,BLA) ein entscheidender Schritt für die Markteinführung neuer Arzneimittel. Das Ministerium für Lebensmittelsicherheit und Arzneimittelzulassung (MFDS) ist in Südkorea für die Prüfung und Genehmigung von NDAs und BLAs zuständig. Das Prüfungsverfahren kann bis zu einhundertachtzig (180) Tage dauern, kann jedoch verkürzt werden, wenn das Arzneimittel als vorrangig zu prüfendes oder beschleunigt zu prüfendes Arzneimittel eingestuft wird.
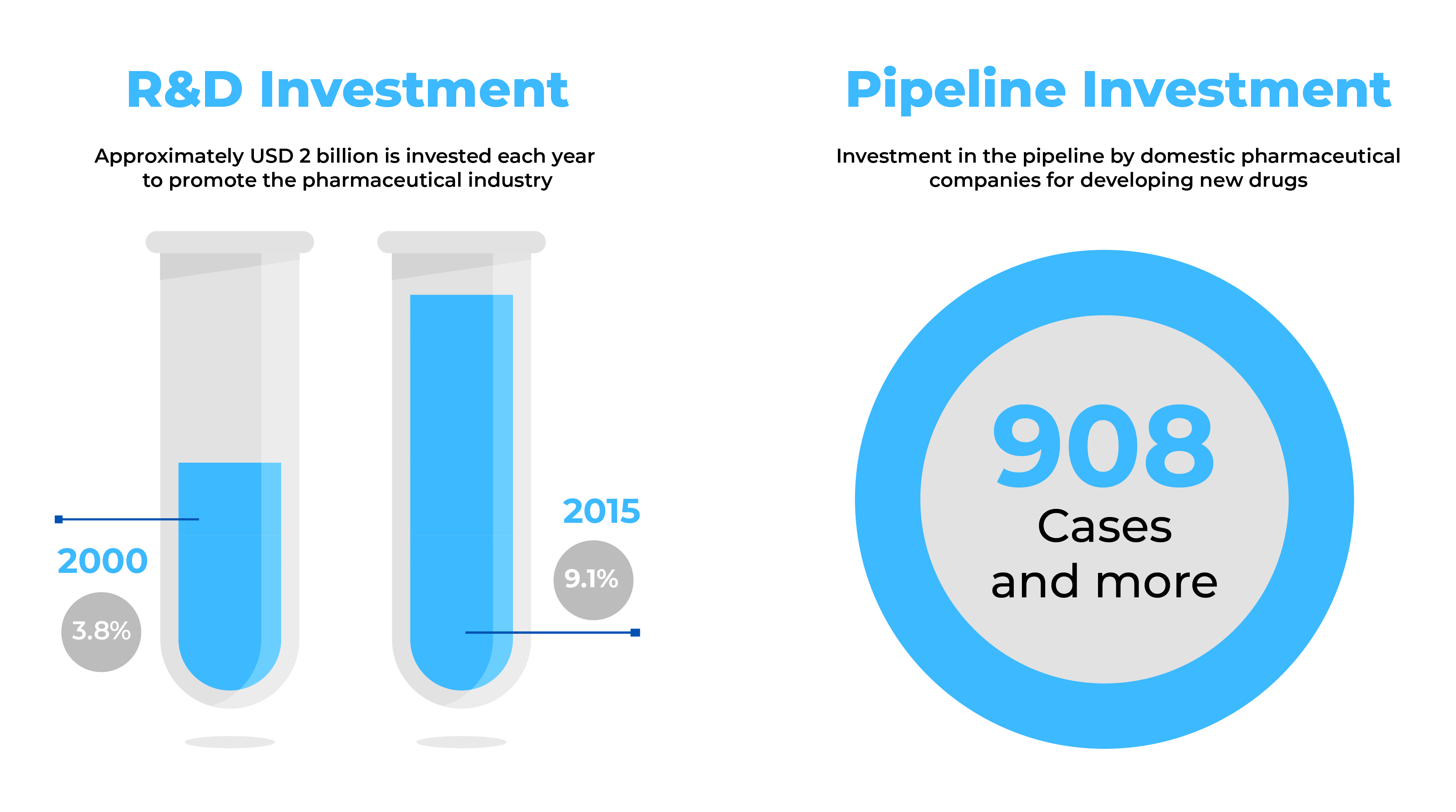
Quelle: Health Industry Trends-September 2014 & Globale Daten (2017)
DieBLA in Südkorea bieten Vorteile wie einen schnelleren Genehmigungsprozess, klare Vorschriften und Anforderungen, die Einbeziehung von Real World Evidence (RWE) und Ausnahmeregelungen für Orphan-Arzneimittel. Allerdings können dieBLA in Südkorea komplex und zeitaufwendig sein. Die Einreichung eines Antrags auf Zulassung eines neuen Arzneimittels (NDA) oder eines Antrags auf Zulassung eines biologischen Arzneimittels (BLA Application,BLA) in Südkorea umfasst mehrere Schritte.
Hier finden Sie einen Überblick über den Prozess:
- Präklinische Tests: Bevor ein Arzneimittel am Menschen geprüft werden kann, muss es zunächst an Tieren getestet werden, um seine Sicherheit und Wirksamkeit zu gewährleisten. In der Regel werden diese Tests an Tieren durchgeführt.
- Klinische Versuche: Nach Abschluss der präklinischen Forschung wird das Medikament in klinischen Studien am Menschen erprobt. Diese Studien sind in drei (03) Phasen unterteilt, die jeweils eine größere Anzahl von Teilnehmern umfassen.
- BLA : Nach Abschluss der klinischen Studien kann der Sponsor einen NDA BLA südkoreanischen Ministerium für Lebensmittelsicherheit und Arzneimittelzulassung (MFDS) einreichen. Der Antrag muss alle fünf (05) Module des elektronischen Common Technical Document (eCTD) enthalten, die nichtklinische, klinische undCMCChemistry, Manufacturing and Controls) umfassen.
- Zulassung: Wenn die MFDS feststellt, dass das Arzneimittel sicher und wirksam ist,BLA derBLA genehmigt. Nach der Zulassung kann das Arzneimittel in Südkorea beworben und verkauft werden.
Beantwortet das immer noch nicht alle Ihre Fragen?
Das sollen die Experten klären.
Um einen detaillierten Einblick inBLA in Südkorea zu erhalten, Freyr ein kostenloses Webinar mit unseren Experten aus Südkorea geplant. Nehmen us „Überblick über denBLA in Südkorea” us , das am 29. November 2023 um 11:30 Uhr IST (ROW) und um 10:00 Uhr EST | 15:00 Uhr GMT | 16:00 Uhr MEZ (Amerika & EUA) stattfindet . Jetzt registrieren ! Bleiben Sie gesund. Bleiben Sie informiert .
Für AMR & EU-Regionen
10: 00 AM EST | 3:00 PM GMT | 4:00 PM CET
Für RoW
11:30 AM IST









